21. (12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选择其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选择其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
 A.生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
A.生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
 (1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式
。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式
。
 (2)根据等电子原理,写出CO分子结构式
。
(2)根据等电子原理,写出CO分子结构式
。
 (3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。

 ①甲醇的沸点比甲醛的高,其主要原因是
;甲醛分子中碳原子轨道的杂化类型为
。
①甲醇的沸点比甲醛的高,其主要原因是
;甲醛分子中碳原子轨道的杂化类型为
。
 ②甲醛分子的空间构型是
;1mol甲醛分子中σ键的数目为 。
②甲醛分子的空间构型是
;1mol甲醛分子中σ键的数目为 。
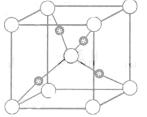
 ③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为
。
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为
。
 [标准答案](1)
[标准答案](1)
 (2)
(2)
 (3)①甲醇分子之间形成氢键
(3)①甲醇分子之间形成氢键  杂化
杂化
 ②平面三角形
3NA
②平面三角形
3NA
 ③4
③4
 [解析](1)Zn的原子序数为30,注意3d轨道写在4s轨道的前面;(2)依据等电子原理,可知CO与N2为等电子体,N2分子的结构式为:互为等电子体分子的结构相似,可写出CO的结构式;(3)甲醇分子之间形成了分子间氢键,甲醛分子间只是分子间作用力,而没有形成氢键,故甲醇的沸点高;甲醛分子中含有碳氧双键,故碳原子轨道的杂化类型为sp2杂化;分子的空间构型为平面型;1mol甲醛分子中含有2mol碳氢δ键,1mol碳氧δ键,故含有δ键的数目为 3NA;依据晶胞示意图可以看出Cu原子处于晶胞内部,所包含的Cu原子数目为4
[解析](1)Zn的原子序数为30,注意3d轨道写在4s轨道的前面;(2)依据等电子原理,可知CO与N2为等电子体,N2分子的结构式为:互为等电子体分子的结构相似,可写出CO的结构式;(3)甲醇分子之间形成了分子间氢键,甲醛分子间只是分子间作用力,而没有形成氢键,故甲醇的沸点高;甲醛分子中含有碳氧双键,故碳原子轨道的杂化类型为sp2杂化;分子的空间构型为平面型;1mol甲醛分子中含有2mol碳氢δ键,1mol碳氧δ键,故含有δ键的数目为 3NA;依据晶胞示意图可以看出Cu原子处于晶胞内部,所包含的Cu原子数目为4
 [考点分析]本题主要考查核外电子排布式、等电子体原理、分子间作用力、杂化轨道、共价键类型、分子的平面构型。
[考点分析]本题主要考查核外电子排布式、等电子体原理、分子间作用力、杂化轨道、共价键类型、分子的平面构型。


 B.环己酮是一种重要的化工原料,实验室常用下列方法制备环己酮:
B.环己酮是一种重要的化工原料,实验室常用下列方法制备环己酮:


 环己醇、环己酮和水的部分物理性质见下表:
环己醇、环己酮和水的部分物理性质见下表:
|
物质 |
沸点(℃) |
密度(g-cm-3,200C) |
溶解性 |
|
环己醇 |
161.1(97.8)* |
0.9624 |
能溶于水 |
|
环己酮 |
155.6(95)* |
0.9478 |
微溶于水 |
|
水 |
100.0 |
0.9982 |
|
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
 (1)酸性Na2Cr2O7溶液氧化环己醇反应的△H<0,反应剧烈将导致体系温度迅速上升,副反应增多。实验中将酸性Na2Cr2O7溶液加到盛有环己醇的烧瓶中,在55-60℃进行反应。反应完成后,加入适量水,蒸馏,收集95-100℃的馏分,得到主要的含环己酮和水的混合物。
(1)酸性Na2Cr2O7溶液氧化环己醇反应的△H<0,反应剧烈将导致体系温度迅速上升,副反应增多。实验中将酸性Na2Cr2O7溶液加到盛有环己醇的烧瓶中,在55-60℃进行反应。反应完成后,加入适量水,蒸馏,收集95-100℃的馏分,得到主要的含环己酮和水的混合物。
 ①酸性Na2Cr2O7溶液的加料方式为 。
①酸性Na2Cr2O7溶液的加料方式为 。
 ②蒸馏不能分离环己酮和水的原因是 。
②蒸馏不能分离环己酮和水的原因是 。
 (2)环己酮的提纯需要经过以下一系列的操作:a蒸馏,收集151-156℃的馏分;b 过滤;c 在收集到的馏分中加NaCl固体至饱和,静置,分液;d 加入无水MgSO4固体,除去有机物中少量水。
(2)环己酮的提纯需要经过以下一系列的操作:a蒸馏,收集151-156℃的馏分;b 过滤;c 在收集到的馏分中加NaCl固体至饱和,静置,分液;d 加入无水MgSO4固体,除去有机物中少量水。
 ①上述操作的正确顺序是 (填字母)。
①上述操作的正确顺序是 (填字母)。
 ②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需 。
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需 。
 ③在上述操作c中,加入NaCl固体的作用是 。
③在上述操作c中,加入NaCl固体的作用是 。
 (3)利用核磁共振氢谱可以鉴定制备的产物是否为环己酮,环己酮分子中有 种不同化学环境的氢原子。
(3)利用核磁共振氢谱可以鉴定制备的产物是否为环己酮,环己酮分子中有 种不同化学环境的氢原子。
 [标准答案](1)①缓慢滴加
[标准答案](1)①缓慢滴加
 ②环已酮和水形成具有固定组成的混合物一起蒸出
②环已酮和水形成具有固定组成的混合物一起蒸出
 (2)①c d b a
(2)①c d b a
 ②漏斗、分液漏斗
②漏斗、分液漏斗
 ③增加水层的密度,有利于分层
③增加水层的密度,有利于分层
 (3)3
(3)3
 [解析](1)为了防止Na2Cr2O7在氧化环己醇放出大量热,使副反应增多,应让其反应缓慢进行,在加入Na2Cr2O7溶液时应缓慢滴加;依据题目信息,环己酮能与水形成具有固定组成的混合物,两者能一起被蒸出;(2)首先加入NaCl固体,使水溶液的密度增大,将水与有机物更容易分离开来,然后向有机层中加入无水MgSO4,出去有机物中少量的水,然后过滤,除去硫酸镁晶体,再进行蒸馏即可;分液需要分液漏斗,过滤还需要漏斗;依据对称性,环己酮中有3种氢。
[解析](1)为了防止Na2Cr2O7在氧化环己醇放出大量热,使副反应增多,应让其反应缓慢进行,在加入Na2Cr2O7溶液时应缓慢滴加;依据题目信息,环己酮能与水形成具有固定组成的混合物,两者能一起被蒸出;(2)首先加入NaCl固体,使水溶液的密度增大,将水与有机物更容易分离开来,然后向有机层中加入无水MgSO4,出去有机物中少量的水,然后过滤,除去硫酸镁晶体,再进行蒸馏即可;分液需要分液漏斗,过滤还需要漏斗;依据对称性,环己酮中有3种氢。
 [考点分析]考查学生的读图、识表能力,能够迅速在图、表中提取到有用信息,利用信息解决有关问题。主要考查知识点还有:过滤、分液以及等效氢等知识。
[考点分析]考查学生的读图、识表能力,能够迅速在图、表中提取到有用信息,利用信息解决有关问题。主要考查知识点还有:过滤、分液以及等效氢等知识。

17. (8分)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(8分)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
 (1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)。
 A.热裂解形成燃油
B.露天焚烧
A.热裂解形成燃油
B.露天焚烧
 C.作为有机复合建筑材料的原料 D.直接填埋
C.作为有机复合建筑材料的原料 D.直接填埋
 (2)用
(2)用 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
的混合溶液可溶出印刷电路板金属粉末中的铜。已知:

 ====
====


 ====
====


 ====
==== 

 在
在 溶液中
溶液中 与
与 反应生成
反应生成 和
和 的热化学方程式为 。
的热化学方程式为 。
 (3)控制其他条件相同,印刷电路板的金属粉末用10℅
(3)控制其他条件相同,印刷电路板的金属粉末用10℅ 和3.0
和3.0 的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
|
温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
铜平均溶解速率 ( ( ) ) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。
 (4)在提纯后的
(4)在提纯后的 溶液中加入一定量的
溶液中加入一定量的 和
和 溶液,加热,生成
溶液,加热,生成 沉淀。制备
沉淀。制备 的离子方程式是
。
的离子方程式是
。
 [标准答案](1)BD
[标准答案](1)BD
 (2) Cu(s)+H2O2 (l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H=-319.68KJ.mol-1
(2) Cu(s)+H2O2 (l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H=-319.68KJ.mol-1
 (3)H2O2 分解速率加快
(3)H2O2 分解速率加快
 (4)2Cu2++SO32-+2Cl-+H2O
(4)2Cu2++SO32-+2Cl-+H2O 2CuCl↓+SO42-+2H+
2CuCl↓+SO42-+2H+
 [解析](1)有关环保的比较容易。(2)主要考察盖斯定律的灵活运用。适当变形,注意反应热的计算。不要忽视热化学方程式的书写的注意事项。(3)考察影响化学反应速率的因素,结合双氧水的性质即可得出答案。(4)根据题目条件书写离子方程式常规题。
[解析](1)有关环保的比较容易。(2)主要考察盖斯定律的灵活运用。适当变形,注意反应热的计算。不要忽视热化学方程式的书写的注意事项。(3)考察影响化学反应速率的因素,结合双氧水的性质即可得出答案。(4)根据题目条件书写离子方程式常规题。
 [考点分析]本题考察的知识比较散,一道题考察了几个知识点。覆盖面比较多。但盖斯定律,热化学方程式,离子方程式都是重点内容
[考点分析]本题考察的知识比较散,一道题考察了几个知识点。覆盖面比较多。但盖斯定律,热化学方程式,离子方程式都是重点内容
15. (10分)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量
(10分)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量 等杂志)生产医药级二水合氯化钙(
等杂志)生产医药级二水合氯化钙( 的质量分数为97.0%~103.0%)的主要流程如下:
的质量分数为97.0%~103.0%)的主要流程如下:


|

 (1)除杂操作是加入氢氧化钙,调节溶液的
(1)除杂操作是加入氢氧化钙,调节溶液的 为8.0~8.5,以出去溶液中的少量
为8.0~8.5,以出去溶液中的少量 。检验
。检验 是否沉淀完全的试验操作是 ▲
。
是否沉淀完全的试验操作是 ▲
。
 (2)酸化操作是加入盐酸,调节溶液的
(2)酸化操作是加入盐酸,调节溶液的 约为4.0,其目的有:①将溶液中的少量
约为4.0,其目的有:①将溶液中的少量 ; ②防止
; ②防止 在蒸发时水解;③ ▲
。
在蒸发时水解;③ ▲
。
 (3)测定样品中
(3)测定样品中 含量的方法是:a.称取0.7500g样品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用0.05000
含量的方法是:a.称取0.7500g样品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用0.05000
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液体积的平均值为20.39mL。
溶液体积的平均值为20.39mL。
 ①上述测定过程中需要溶液润洗的仪器有 ▲
。
①上述测定过程中需要溶液润洗的仪器有 ▲
。
 ②计算上述样品中
②计算上述样品中 的质量分数为 ▲
。
的质量分数为 ▲
。
 ③若用上述办法测定的样品中
③若用上述办法测定的样品中 的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有 ▲
; ▲
。
的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有 ▲
; ▲
。
 [标准答案](1)取少量上层清液,滴加KSCN溶液,,若不出现血红色,则表明Fe(OH)3 沉淀完全。
[标准答案](1)取少量上层清液,滴加KSCN溶液,,若不出现血红色,则表明Fe(OH)3 沉淀完全。
 (2)防止溶液吸收空气中CO2
(2)防止溶液吸收空气中CO2
 (3)①酸式滴定管
(3)①酸式滴定管
 ②99.9%
②99.9%
 ③样品中存在少量的NaCl
少量的CaCl2 .2H2O失水
③样品中存在少量的NaCl
少量的CaCl2 .2H2O失水
 [解析](1)实质是检验Fe3+是否存在的,选用KSCN溶液。这问比较简单(2)此问学生比较难回答出来,如果吸收了少量的CO2 会导致最终质量分数偏低(3)①标准液为硝酸银溶液,所以用酸式滴定管。在使用前应先用硝酸银溶液进行润洗。② 根据到达滴定终点生成氯化银的物质的量等于消耗硝酸银溶液的物质的量这一关系求出消耗硝酸银的物质的量,然后n(AgCl)=0.5n(CaCl2.2H2O)据此可以算出实际上的CaCl2.2H2O的物质的量,进而求出质量。注意的是我们是从250mol中取25ml,所以在计算时要注意这一点,就不会错了。③样品中存在少量的NaCl据 n(AgCl)=0.5n(CaCl2.2H2O) ,CaCl2.2H2O的物质的量增大。同样若CaCl2 .2H2O失水导致分母变小,值偏大。
[解析](1)实质是检验Fe3+是否存在的,选用KSCN溶液。这问比较简单(2)此问学生比较难回答出来,如果吸收了少量的CO2 会导致最终质量分数偏低(3)①标准液为硝酸银溶液,所以用酸式滴定管。在使用前应先用硝酸银溶液进行润洗。② 根据到达滴定终点生成氯化银的物质的量等于消耗硝酸银溶液的物质的量这一关系求出消耗硝酸银的物质的量,然后n(AgCl)=0.5n(CaCl2.2H2O)据此可以算出实际上的CaCl2.2H2O的物质的量,进而求出质量。注意的是我们是从250mol中取25ml,所以在计算时要注意这一点,就不会错了。③样品中存在少量的NaCl据 n(AgCl)=0.5n(CaCl2.2H2O) ,CaCl2.2H2O的物质的量增大。同样若CaCl2 .2H2O失水导致分母变小,值偏大。
 [考点分析]此题主要考查实验的基本操作、实验仪器的选择、实验误差分析。因此实验基础的考察依然是以后学习和复习的重点。
[考点分析]此题主要考查实验的基本操作、实验仪器的选择、实验误差分析。因此实验基础的考察依然是以后学习和复习的重点。 

 N2O4(g)达到平衡。
N2O4(g)达到平衡。 N2O4(g)的平衡常数K。
N2O4(g)的平衡常数K。 ;
; 




 ===
=== 可得
可得

 苯乙酸乙酯(用合成路线流程图表示,并注明反应条件)。
苯乙酸乙酯(用合成路线流程图表示,并注明反应条件)。 CH3CH2OH
CH3CH2OH  H2C=CH2
BrH2C-CH2Br
H2C=CH2
BrH2C-CH2Br 
 是一种在水处理等方面有广泛应用的高效安全消毒剂。与
是一种在水处理等方面有广泛应用的高效安全消毒剂。与 相比,
相比, 不但具有更显著地杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
不但具有更显著地杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。 ====
====
 ====
====
 .2001年我国卫生部规定,饮用水
.2001年我国卫生部规定,饮用水 的含量应不超过0.2
的含量应不超过0.2 。
。 还原为
还原为 的转化率与溶液PH的关系如右图所示。当
的转化率与溶液PH的关系如右图所示。当 时,
时,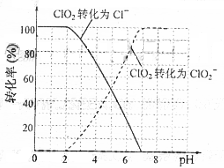 完全还原成
完全还原成 用标准
用标准 溶液滴定:
溶液滴定: ====
====
 水样加入到锥形瓶中。
水样加入到锥形瓶中。 晶体。
晶体。

 .
.


 [解析](1)比较简单,观察两组方程式,看看产物结合其性质即能得出答案。(2)
[解析](1)比较简单,观察两组方程式,看看产物结合其性质即能得出答案。(2)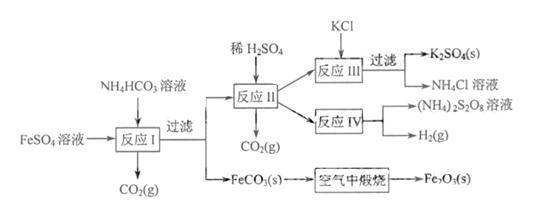
 溶液中加入 ▲
(填字母),以除去溶液中的
溶液中加入 ▲
(填字母),以除去溶液中的 。
。
 (过二硫酸铵)。电解时均用惰性电极,阳极发生地电极反应可表示为
。
(过二硫酸铵)。电解时均用惰性电极,阳极发生地电极反应可表示为
。 2S2O82-
2S2O82-
 的物质的量浓度c(
的物质的量浓度c(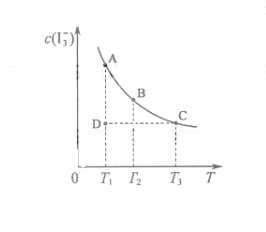
 ,反应的平衡常数分别为
,反应的平衡常数分别为

 的浓度逐渐的减小,说明反应向逆方向移动,也就意味着该反应是放热反应,所以
的浓度逐渐的减小,说明反应向逆方向移动,也就意味着该反应是放热反应,所以 ,所以A项错;因为
,所以A项错;因为 ,
, ,所以当温度升高时,反应向逆方向移动,即
,所以当温度升高时,反应向逆方向移动,即 ;C项,从图中可以看出D点并没有达到平衡状态,所以它要向A点移动,这时
;C项,从图中可以看出D点并没有达到平衡状态,所以它要向A点移动,这时 溶液中滴加
溶液中滴加 溶液至中性:
溶液至中性:
 溶液:
溶液:
 、浓度均为0.1
、浓度均为0.1 混合溶液:
混合溶液: