13. 在一体积可变的密闭容器中,加入一定量的X、Y,发生反应
在一体积可变的密闭容器中,加入一定量的X、Y,发生反应

 kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气
kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气
 体体积的关系如下表所示:
体体积的关系如下表所示:
 气体体积 气体体积 C(Y)/mol·L-1 C(Y)/mol·L-1  温度℃ 温度℃ |
1 |
2 |
3 |
|
100 |
1.00 |
0.75 |
0.53 |
|
200 |
1.20 |
0.09 |
0.63 |
|
300 |
1.30 |
1.00 |
0.70 |
下列说法正确的是
 A.m>n
A.m>n
 B.Q<0
B.Q<0
 C.温度不变,压强增大,Y的质量分数减少
C.温度不变,压强增大,Y的质量分数减少
 D.体积不变,温度升高,平衡向逆反应方向移动
D.体积不变,温度升高,平衡向逆反应方向移动

 答案C
答案C
 [解析] 根据题目信息可得,在温度相同的条件下,当体积扩大到原来的两倍时,Y的浓度降低的倍数小于2,所以可确定增大体积,平衡正向移动,根据平衡移动原理,增大体积,平衡向体积增大的方向移动,因此A错误,C项正确。当体积相同时,温度升高,Y的浓度增大,即平衡正向移动,所以此反应的正向为放热反应,B、D错误。
[解析] 根据题目信息可得,在温度相同的条件下,当体积扩大到原来的两倍时,Y的浓度降低的倍数小于2,所以可确定增大体积,平衡正向移动,根据平衡移动原理,增大体积,平衡向体积增大的方向移动,因此A错误,C项正确。当体积相同时,温度升高,Y的浓度增大,即平衡正向移动,所以此反应的正向为放热反应,B、D错误。
 [考点分析]化学平衡移动原理
[考点分析]化学平衡移动原理

7.下列有关物质检验的实验结论正确的是
|
选项 |
实 验 操 作 及 现 象 |
实 验 结 论 |
|
A |
向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 |
该溶液中一定含有 |
|
B |
向某溶液中加入2滴KSCN溶液,溶液不显红色。再向溶液中加入几滴新制的氯水,溶液变为红色 |
该溶液中一定含有 |
|
C |
将某气体通入品红溶液中,品红溶液褪色 |
该气体一定是 |
|
D |
将少量某物质的溶液滴加到新制的银氨溶液中,水浴加热后有银镜生成 |
该物质一定属于醛类 |
答案B
[解析]A项可能受到Ag+影响生成AgCl沉淀;C能够使品红溶液褪色的气体不一定就是 还可能是其他气体比如氯气;D、能发生银镜反应的官能团为醛基,而醛基还可能存在与甲酸或甲酸某酯、甲酸盐中。
还可能是其他气体比如氯气;D、能发生银镜反应的官能团为醛基,而醛基还可能存在与甲酸或甲酸某酯、甲酸盐中。
[考点分析]常见离子检验、物质鉴别综合运用

 )+c(NH3·H2O)
)+c(NH3·H2O) B.
B. C.n=m+17Vc D.
C.n=m+17Vc D.
 <
<  <
<
 。下列说法正确的是
。下列说法正确的是 、M
、M (aq)+2OH
(aq)+2OH O(1);
O(1); H=
H= 57.3 kJ/mol
57.3 kJ/mol H
H O
O 、
、
 、
、

 =0.1 mol/L的溶液:Na+、K+、
=0.1 mol/L的溶液:Na+、K+、 、
、 答案
答案

 2SO3。
2SO3。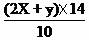 ×100%=(0.04+0.064)
×14/10×100%=14.56%
×100%=(0.04+0.064)
×14/10×100%=14.56%
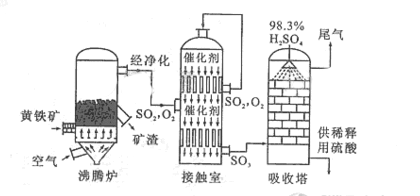


 的转化率
的转化率 气体与
气体与 化合放出260.6kJ的热量,该反应的热化学方程是 。
化合放出260.6kJ的热量,该反应的热化学方程是 。 。
。 溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。