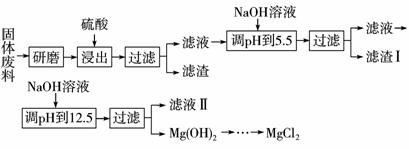
12.(2009年广东卷)某厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:
|
沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
pH |
3.2 |
5.2 |
12.4 |
部分阳离子以氢氧化物形式完全沉淀时溶液的pH见上表,请回答下列问题:
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有_______________(要求写出两条)
(2)滤渣Ⅰ的主要成分有____________。
(3)从滤液Ⅱ中可回收利用的主要物质有____________。
(4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
 MgCl2+2NaClO3=Mg(ClO3)2+2NaCl
MgCl2+2NaClO3=Mg(ClO3)2+2NaCl
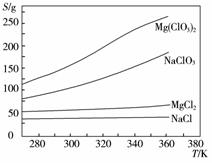
已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因:_________________。
②按①中条件进行制备实验。在冷却降温析出Mg
(ClO3)2过程中,常伴有NaCl析出,原因是:
_______________。除去产品中该杂质的方法是:____________。
8.下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的是( )
|
|
A |
B |
C |
D |
|
X |
FeCl2溶液 |
FeCl3溶液 |
Fe |
Na2SO4溶液 |
|
Y |
FeCl3 |
CuCl2 |
Al |
Na2CO3 |
|
Z |
Fe |
Fe |
NaOH溶液 |
BaCl2溶液 |