有比较才能有鉴别,有比较才会找出差异,从而强化思考、理解与记忆。如:
|
|
同位素
|
同素异形体 |
同系物 |
同分异构体 |
|
对象差异 |
针对简单原子、离子[来 |
针对单质 |
针对有机物 |
针对化合物 |
|
判断依据 |
质子数、中子数 |
组成结构
|
官能团,-CH2- |
分子式、结构 |
|
各自性质 特征 |
物理性质不同 化学性质相同 |
物理性质不同 化学性质一般相同 |
物理性质不同 化学性质相似 |
物理性质不同 化学性质相似或不同 |
考点一 物质的量与阿伏加德罗常数
[例1]设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.标准状况下,NA个SO3分子所占的体积约为22.4 L
B.在反应CaO+3C
CaC2+CO↑中,生成1 mol
CO,转移的电子数为3NA
C.1.8 g重水(D2O)中所含质子的个数为NA
D.7 g CnH2n中含有的氢原子数目为NA
 变式1用NA表示阿伏加德罗常数,下列说法正确的是
变式1用NA表示阿伏加德罗常数,下列说法正确的是
A.0.2 mol过氧化氢完全分解转移的电子数目为0.4NA
B.300 mL 2 mol/L蔗糖溶液中所含分子数为0.6 NA
C.含1mol H2O的冰中,氢键的数目为4NA
D.在标准状况下,2.24 L二氧化硫与氧气混合气体中所含氧原子数为0.2 NA
考点二 物质的变化
[例2]下列过程中不涉及化学变化的是
A.用热的纯碱溶液洗涤油污 B.用少量食醋除去水壶中的水垢
C.白磷在一定条件下转化为红磷 D.用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐
[解析]本题考查的是物理变化和化学变化的辨析。用热的纯碱洗涤油污,涉及碳酸根离子的水解及酯类物质在碱性条件下的水解;用少量食醋除去水壶中的水垢主要是醋酸与碳酸钙反应;白磷转化为红磷时存在旧键的断裂和新键的形成,因此上述这些变化均为化学变化;而用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐是渗析,是物理变化。所以答案为D。
变式2据央视国际频道报道,近日中国科学家率先建成了世界上第一个全超导核聚变“人造太阳”实验装置,模拟太阳产生能量。报道描述说,这个装置从内到外一共有五层部件构成,最内层的环行磁容器像一个巨大的游泳圈,进入实验状态后,“游泳圈”内部将达到上亿度的高温,这也正是模拟太阳聚变反应的关键部位。“人造太阳”实验装置正是起着这一转化作用,通过磁力线的作用,氢的同位素等离子体被约束在这个“游泳圈”中运行,发生高密度的碰撞,也就是聚变反应。下列有关说法中不正确的是
A.“人造太阳”可为人类提供清洁的核聚变能源
B.氢的同位素氘和氚可以从海水中大量提取
C.“人造太阳”实验装置中发生的聚变反应是化学反应
D.氢的同位素有氕、氘、氚三种,它们构成的双原子分子有6种
考点三:化学用语
 [例3]下列化学用语的书写,正确的是
[例3]下列化学用语的书写,正确的是
A.乙烯的结构简式:CH2CH2 B.氯离子的结构示意图:
C.溴化钠的电子式: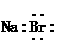 D.辛烷的分子式:C7H16
D.辛烷的分子式:C7H16
[精析] 乙烯的结构简式为CH2=CH2;NaBr的电子式为 ;辛烷的分子式为C8H18。答案为B。
;辛烷的分子式为C8H18。答案为B。
变式3化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A.钢铁腐蚀时可能发生的反应(正极):2H2O+O2-4e-=4OH-
B.1 L、0.5 mol/L稀硫酸与1 L、1 mol/LNaOH溶液反应放出57.3kJ的热
H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+H2O(l);△H=+114.6 kJ/mol
C.碳酸氢铵溶液与足量的烧碱溶液反应:NH4++OH-=NH3·H2O
D.碳酸氢钠溶液与足量澄清石灰水反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
考点四 溶液和胶体
[例4]下列判断正确的是
A.任何溶胶加入可溶性电解质后都能使胶体粒子凝成较大颗粒形成沉淀析出
B.丁达尔现象、布朗运动、电泳现象都是胶体的物理性质
C.因为胶粒比溶液中溶质粒子大,所以胶体可以用过滤的方法把胶粒分离出来
D.相同条件下,相同溶质的溶液,饱和溶液不一定比不饱和溶液浓一些
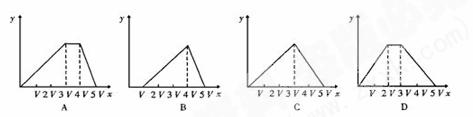
 变式4将物质的量相等的硫酸铵和硫酸铝溶于水形成VmL混合溶液,向混合溶液中逐滴加入某氢氧化钠的溶液(其物质的量浓度为混合溶液中两溶质的物质的量浓度之和),直至过量。下列表示氢氧化钠溶液加入的体积(x)与溶液中沉淀物的量(y)的关系示意图中正确的是
变式4将物质的量相等的硫酸铵和硫酸铝溶于水形成VmL混合溶液,向混合溶液中逐滴加入某氢氧化钠的溶液(其物质的量浓度为混合溶液中两溶质的物质的量浓度之和),直至过量。下列表示氢氧化钠溶液加入的体积(x)与溶液中沉淀物的量(y)的关系示意图中正确的是
考点五 物质的结构
[例5] X是由两种短周期元素构成的离子化合物,1mol X含有20 mol 电子。下列说法不正确的是
A.晶体中阳离子和阴离子所含电子数一定相等
B.晶体中一定只有离子键没有共价键
C.所含元素一定不在同一周期也不在第一周期
D.晶体中阳离子半径一定小于阴离子半径
 变式5共价键、离子键和范德瓦耳斯力都是微观粒子之间的不同作用力,下列物质: ①Na2O2;② SiO2;③ 石墨;④ 金刚石;⑤ FeS2;⑥ 白磷,其中含有两种作用力的组合是
变式5共价键、离子键和范德瓦耳斯力都是微观粒子之间的不同作用力,下列物质: ①Na2O2;② SiO2;③ 石墨;④ 金刚石;⑤ FeS2;⑥ 白磷,其中含有两种作用力的组合是
A.①③⑤⑥ B.①③⑥ C.②④⑥ D.①②③⑥
 考点六 热化学方程式与反应中的能量变化
考点六 热化学方程式与反应中的能量变化
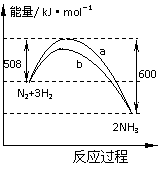
[例6]右图是198K时N2与H2反应过程中能量变化的曲线图。下列叙
述正确的是
A.该反应的热化学方程式为:
N2+3H2  2NH3,△H=-92kJ·mol-1
2NH3,△H=-92kJ·mol-1
B.a曲线是加入正催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热改变
D.在温度体积一定的条件下,通入1molN2和3molH2反应后放出的热量为Q1kJ,若通入2 molN2和6 molH2反应后放出的热量为Q2kJ则184>Q2 >2Q1
[解析]A项热化学方程式中没有注明各物质的聚集状态,B项中加入催化剂,降低了反应的活化能,反应速率加快,应为b曲线;C项中加入催化剂同等程度地改变正逆反应,对化学反应的反应热无影响;D项中,每生成2molNH3放出92 kJ的能量,由于反应为可逆反应,2 molN2和6 molH2反应后不可能完全转化为2molNH3,所以放出的热量小于184 kJ,通入1molN2和3molH2反应放热Q1kJ,当在同一条件下,放入2 molN2和6 molH2时,由于压强增大,平衡正向移动,NH3的含量增加,所以放出的热量大于2Q1。
变式6科学家发现,不管化学反应是一步完成或分几步完成,该反应的热效应是相同的。已
知在25℃,105Pa时,石墨、一氧化碳的燃烧热分别是393.5 kJ·mol-1和283.0 kJ·mol-1,下列
说法或方程式正确的是
A.在相同条件下:2C(石墨)+O2(g)=2CO(g);ΔH=-110.5 kJ·mol-1
B.1 mol石墨不完全燃烧,生成CO2和CO混合气体时,放热504.0 kJ
C.在相同条件下:C(石墨)+CO2(g)=2CO(g);ΔH=-172.5 kJ·mol-1
D.若金刚石燃烧热大于石墨的燃烧热,则石墨转变为金刚石需要吸热
 H++Cl-+HClO,再通入少量氯气后,c(H+)与c(HClO)同等程度增大,若HClO的电离程度不变,c(H+)/c(ClO-)应该相等,但实际上HClO的电离程度减小,使c(ClO-)增大倍数不够,所以c(H+)/c(ClO-)增大,SO2与Cl2反应而使溶液漂白性减弱,B错。据电荷守恒有:
H++Cl-+HClO,再通入少量氯气后,c(H+)与c(HClO)同等程度增大,若HClO的电离程度不变,c(H+)/c(ClO-)应该相等,但实际上HClO的电离程度减小,使c(ClO-)增大倍数不够,所以c(H+)/c(ClO-)增大,SO2与Cl2反应而使溶液漂白性减弱,B错。据电荷守恒有: 变式1 X、Y、Z为短周期元素,X的最外层电子数是Y原子最外层电子数的2倍,Y的原子序数比X的原子序数多5,Z原子的最外层电子数比Y多3。下列叙述正确的是
变式1 X、Y、Z为短周期元素,X的最外层电子数是Y原子最外层电子数的2倍,Y的原子序数比X的原子序数多5,Z原子的最外层电子数比Y多3。下列叙述正确的是 [例3]在一定温度下,向体积恒定为2L的密闭容器里充入2mol M和一定量的N,发生如下反应:M(g)+N(g) E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2mol·L-1。下列说法正确的是
[例3]在一定温度下,向体积恒定为2L的密闭容器里充入2mol M和一定量的N,发生如下反应:M(g)+N(g) E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2mol·L-1。下列说法正确的是 
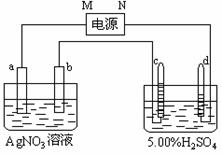 [例5]图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体。回答:
[例5]图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体。回答: 00%x=5.02%(x-0.18),解得:x=45.18g。
00%x=5.02%(x-0.18),解得:x=45.18g。 (4)使用了较浓的硝酸,产物中有部分二氧化氮生成。
(4)使用了较浓的硝酸,产物中有部分二氧化氮生成。