摘要:4.B 原反应为:Cl2+H2OH++Cl-+HClO.再通入少量氯气后.c(H+)与c同等程度增大.若HClO的电离程度不变.c(H+)/c(ClO-)应该相等.但实际上HClO的电离程度减小.使c(ClO-)增大倍数不够.所以c(H+)/c(ClO-)增大.SO2与Cl2反应而使溶液漂白性减弱.B错.据电荷守恒有: c(Na+)+c(H+) = c(Cl-)+c(ClO-)+c(OH-).当溶液呈中性时.c(H+) = c(OH-).才有c(Na+)=c(Cl-)+ c(ClO-).C错.D中加入少量的水.相当于增大了水的量.c(H+)下降.对水的电离的抑制作用减弱.水的电离平衡向正反应方向移动.D正确.
网址:http://m.1010jiajiao.com/timu3_id_69546[举报]
工业上利用反应3Cl2+8NH3═N2+6NH4Cl检查氯气管道是否漏气.下列说法错误的是( )
| A、若管道漏气遇氨就会产生白烟 | B、该反应利用了Cl2的强氧化性 | C、该反应中NH3被还原 | D、该反应中氧化剂与还原剂的物质的量之比为3:2 |
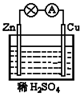 在如图所示的原电池中,下列说法正确的是( )
在如图所示的原电池中,下列说法正确的是( )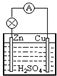 在如图所示的原电池中,下列说法正确的是( )
在如图所示的原电池中,下列说法正确的是( ) 铜锌原电池(如图)工作时,下列叙述正确的是( )
铜锌原电池(如图)工作时,下列叙述正确的是( )