网址:http://m.1010jiajiao.com/timu3_id_69550[举报]
(1)试用化学方程式表示工业制取漂白粉的过程:
(2)已知浓盐酸和漂白粉中的成分之一次氯酸钙能发生如下反应:
Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O用贮存很久的漂白粉与浓盐酸反应制得的氯气中,可能含有的杂质气体是
①CO2 ②HCl ③H2O ④O2
A.①②③B.②③④C.②③D.①④
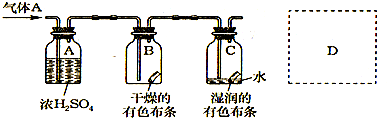
(3)某学生应用如图所示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.回答下列问题:
①该项研究(实验)的主要目的是
②浓H2SO4的作用是
③这样的实验设计还存在事故隐患,请在图中的D处画出能克服该缺陷的装置

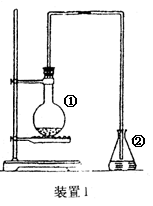
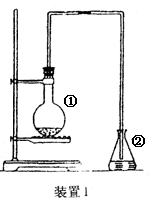
为探究苯与溴的取代反应,甲用下图装置I进行如下实验:
将一定量的苯和溴放在烧瓶中,同时加入少量铁屑做催化剂,3-5分钟后发现滴有AgNO3的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应。
(1)装置I中①的化学方程式为______________________。②中离子方程式为_______________________。
(2)①中长导管的作用是______________________________________。
(3)烧瓶中生成的红褐色油状液滴的成分是_____________,要想得到纯净的产物,可用NaOH溶液试剂洗涤。洗涤后分离粗产品应使用的仪器是_________。
(4)甲做实验时,乙观察到烧瓶中液体沸腾并有红棕色气体从导管中逸出,提出必须先除去红棕色气体,才能验证锥形瓶中的产物。原因是________________________________________________。
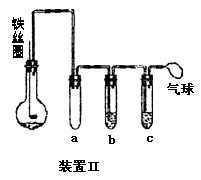
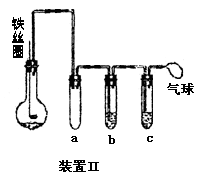
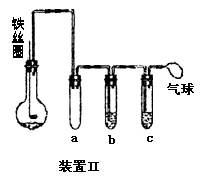
(5)乙同学设计右图所示装置Ⅱ,并用下列某些试剂完成该实验。可选用的试剂是:苯;液溴;浓硫酸;氢氧化钠溶液;硝酸银溶液;四氯化碳。
a的作用是__________________________。
b中的试剂是________________________。
比较两套装置,装置Ⅱ的主要优点是____________________________。
为探究苯与溴的取代反应,甲用下图装置I进行如下实验:
将一定量的苯和溴放在烧瓶中,同时加入少量铁屑做催化剂,3-5分钟后发现滴有AgNO3的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应。
(1)装置I中①的化学方程式为______________________。②中离子方程式为_______________________。
(2)①中长导管的作用是______________________________________。
(3)烧瓶中生成的红褐色油状液滴的成分是_____________,要想得到纯净的产物,可用NaOH溶液试剂洗涤。洗涤后分离粗产品应使用的仪器是_________。
(4)甲做实验时,乙观察到烧瓶中液体沸腾并有红棕色气体从导管中逸出,提出必须先除去红棕色气体,才能验证锥形瓶中的产物。原因是________________________________________________。
(5)乙同学设计右图所示装置Ⅱ,并用下列某些试剂完成该实验。可选用的试剂是:苯;液溴;浓硫酸;氢氧化钠溶液;硝酸银溶液;四氯化碳。
a的作用是__________________________。
b中的试剂是________________________。
比较两套装置,装置Ⅱ的主要优点是____________________________。
为探究苯与溴的取代反应,甲用下图装置I进行如下实验:
将一定量的苯和溴放在烧瓶中,同时加入少量铁屑做催化剂,3-5分钟后发现滴有AgNO3的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应。
(1)装置I中①的化学方程式为______________________。②中离子方程式为_______________________。
(2)①中长导管的作用是______________________________________。
(3)烧瓶中生成的红褐色油状液滴的成分是_____________,要想得到纯净的产物,可用NaOH溶液试剂洗涤。洗涤后分离粗产品应使用的仪器是_________。
(4)甲做实验时,乙观察到烧瓶中液体沸腾并有红棕色气体从导管中逸出,提出必须先除去红棕色气体,才能验证锥形瓶中的产物。原因是________________________________________________。
(5)乙同学设计右图所示装置Ⅱ,并用下列某些试剂完成该实验。可选用的试剂是:苯;液溴;浓硫酸;氢氧化钠溶液;硝酸银溶液;四氯化碳。
a的作用是__________________________。
b中的试剂是________________________。
比较两套装置,装置Ⅱ的主要优点是____________________________。

把煤作为燃料可通过下列两种途径:
途径Ⅰ:C(s)+O2(g)=CO2(g) ΔH1=E1
途径Ⅱ:先制水煤气:C(s)+H2O(g)=CO(g)+H2(g) ΔH2=E2
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g) ΔH3=E3
2H2(g)+O2(g)=2H2O(g) ΔH4=E4
请回答下列问题:
(1)与途径Ⅰ相比较,途径Ⅱ的优点有________________.
(2)上述反应中ΔH>0的是________.理论上等质量的煤分别按上述两途径产生可利用的总能量正确的关系是________.
A.Ⅰ多于Ⅱ B.Ⅰ少于Ⅱ C.Ⅰ等于Ⅱ
(3)根据所学理论可推知E1、E2、E3、E4的关系是________.
(4)由于制水煤气的反应中,反应物具有的总能量________(填“大于”“等于”或“小于”)生成物具有的总能量,那么在反应时,反应物就需要________(填“吸收”或“释放”)能量才能转化为生成物,因此其反应条件为________.