摘要:电解质理论重点考查弱电解质电离平衡的建立.电离方程式的书写.外界条件对电离平衡的影响.酸碱中和反应中有关弱电解质参与的计算和酸碱中和滴定实验原理.水的离子积常数及溶液中水电离的氢离子浓度的有关计算和pH的计算.溶液酸碱性的判断.不同电解质溶液中水的电离程度大小的比较.盐类的水解原理及应用.离子共存.离子浓度大小比较.电解质理论与生物学科之间的渗透等.重要知识点有:1.弱电解质的电离平衡及影响因素.水的电离和溶液的pH及计算.
网址:http://m.1010jiajiao.com/timu3_id_69541[举报]
某校科技活动小组用镁粉、盐酸、醋酸设计以下实验,对两种酸分别与镁反应的速率和电离平衡理论进行研究,设计的实验装置如图所示(夹持固定装置已略去).
正确操作,记录得到下图2中部分实验数据.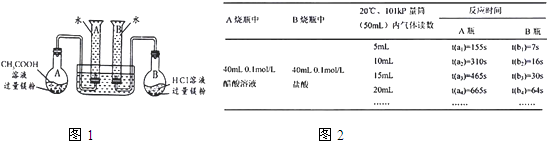
分析数据,观察实验装置图,回答下列问题:
(1)组装完成后,某同学发现该装置在设计上存在明显缺陷:根本无法完成实验,甚至存在危险,其缺陷在于
经小组研究后,稍作改进就可继续实验了;
(2)欲配置100mL实验所需浓度的盐酸,除烧杯、酸式滴定管、胶头滴管之外,还需用到的主要玻璃仪器是
(3)在实验数据中
①t(a1)远远大于t(b1)的原因为:
②由
(4)该实验得到什么结论?(回答出两点即可)
①
②
(5)通过实验判断,锌与稀盐酸制氢气时,若要减慢反应速率而不影响产生氢气的量,可以加入
查看习题详情和答案>>
正确操作,记录得到下图2中部分实验数据.

分析数据,观察实验装置图,回答下列问题:
(1)组装完成后,某同学发现该装置在设计上存在明显缺陷:根本无法完成实验,甚至存在危险,其缺陷在于
量筒口胶塞的使用,使得反应产生的H2无法进入量筒(当反应开始之后,会造成烧瓶或量筒的胶塞被气体强力推出而发生危险)
量筒口胶塞的使用,使得反应产生的H2无法进入量筒(当反应开始之后,会造成烧瓶或量筒的胶塞被气体强力推出而发生危险)
;经小组研究后,稍作改进就可继续实验了;
(2)欲配置100mL实验所需浓度的盐酸,除烧杯、酸式滴定管、胶头滴管之外,还需用到的主要玻璃仪器是
容量瓶(100mL)、玻璃棒
容量瓶(100mL)、玻璃棒
;(3)在实验数据中
①t(a1)远远大于t(b1)的原因为:
开始阶段醋酸溶液中的c(H+)远小于相同浓度的盐酸中的c(H+)
开始阶段醋酸溶液中的c(H+)远小于相同浓度的盐酸中的c(H+)
;②由
t(b3)-t(b2)>t(b2)-t(b1)或t(b3)>t(b1)+t(b2)
t(b3)-t(b2)>t(b2)-t(b1)或t(b3)>t(b1)+t(b2)
[用含t(b1)、t(b2)、t(b3)代数式表示]说明盐酸是强酸,不存在电离平衡;由t(a3)-t(a2)=t(a2)-t(a1)或t(a3)=t(a1)+t(a2)
t(a3)-t(a2)=t(a2)-t(a1)或t(a3)=t(a1)+t(a2)
[用含t(a1)、t(a2)、t(a3)代数式表示]说明醋酸中存在电离平衡.(4)该实验得到什么结论?(回答出两点即可)
①
相同物质的量浓度的盐酸、醋酸与金属反应时,盐酸开始反应速率大(过一段时间,醋酸与镁反应速率较盐酸的快)
相同物质的量浓度的盐酸、醋酸与金属反应时,盐酸开始反应速率大(过一段时间,醋酸与镁反应速率较盐酸的快)
;②
盐酸是强电解质,醋酸是弱电解质(存在电离平衡)
盐酸是强电解质,醋酸是弱电解质(存在电离平衡)
.(5)通过实验判断,锌与稀盐酸制氢气时,若要减慢反应速率而不影响产生氢气的量,可以加入
CH3COONa固体、水或NaCl溶液
CH3COONa固体、水或NaCl溶液
(填写两种不同作用原理的物质).下列关于强、弱电解的说法中正确的是( )
查看习题详情和答案>>
| A.强酸、强碱及大部分盐类属于强电解质,弱酸弱碱属于弱电解质 |
| B.所有的离子化合物都是强电解质,所有的共价化合物都是弱电解质 |
| C.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 |
| D.CO2的水溶液能导电,本身又是化合物,所以它是电解质 |
下列关于强、弱电解的说法中正确的是( )
A.强酸、强碱及大部分盐类属于强电解质,弱酸弱碱属于弱电解质
B.所有的离子化合物都是强电解质,所有的共价化合物都是弱电解质
C.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
D.CO2的水溶液能导电,本身又是化合物,所以它是电解质
查看习题详情和答案>>
A.强酸、强碱及大部分盐类属于强电解质,弱酸弱碱属于弱电解质
B.所有的离子化合物都是强电解质,所有的共价化合物都是弱电解质
C.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
D.CO2的水溶液能导电,本身又是化合物,所以它是电解质
查看习题详情和答案>>
电解原理在化学:工业中有广泛应用。下图所示为一种电解装置,G为自流电源,a、b为电极,U形管中装有电解质溶液W(500 mL,设电解前后溶液的体积不变),X、Y是两块电极板,通过导线与直流电源相连。请回答下列问题:
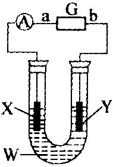
(1)利用电解原理在如图装置中完成粗铜提纯,则电解质溶液W为_________,阳极材料X为_________;
(2)已知直流电源G为高铁电池,高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压,高铁电池的总反应式为:
3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH则b电极反应式为_________;放电时每转移3 mol电子,正极有_________mol_________被还原;
3Zn(OH)2+2Fe(OH)3+4KOH则b电极反应式为_________;放电时每转移3 mol电子,正极有_________mol_________被还原;
(3)若X、X为石墨板,W为CuSO4溶液,电解一段时间后,向电解后的残留液中加入足量铁粉充分反应,过滤、蒸干、称重,发现铁粉增重3.2g;洗净、烘干、称重,发现Y板增重1.6 g。则从理论上讲,电解过程中高铁电池的锌电极质量减少_________g;电解后溶液pH为_________;原CuSO4溶液的物质的量浓度为_________mol·L-1。
查看习题详情和答案>>