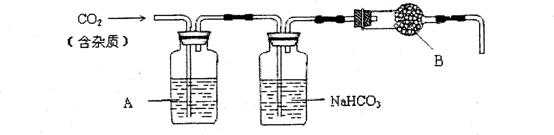
14.(2010年广东)某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(1)请完成SO2与过量NaOH溶液反应的化学方程式:SO2+2NaOH = ________________.
(2)反应Cl2+Na2SO3+2 NaOH===2NaCl+Na2SO4+H2O中的还原剂为________________.
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl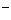 、OH
、OH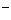 和SO
和SO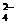 .请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
① 提出合理假设 .
假设1:只存在SO32-;假设2:既不存在SO32-也不存在ClO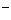 ;假设3:_____________.
;假设3:_____________.
② 设计实验方案,进行实验。请在答题卡上写出实验步骤以及预期现象和结论。限选实验试剂:3moL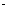 L-1H2SO4、1moL
L-1H2SO4、1moL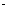 L-1NaOH、0.01mol
L-1NaOH、0.01mol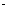 L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
|
实验步骤 |
预期现象和结论 |
步骤1:取少量吸收液于试管中,滴加3 moL L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. |
 |
|
步骤2: |
|
|
步骤3: |
|
解析:(1) SO2是亚硫酸对应的酸酐,当NaOH过量时,生成的是正盐,反应的方程式为:SO2+2NaOH =Na2SO3+H2O。
(2)从方程式中前后元素的价态变化可以看出,S元素的价态从+4→+6,失去电子表现为还原性,故还原剂为Na2SO3。
(3)①很明显,假设3两种离子都存在。
②根据两种离子的性质可以鉴别。SO32-、ClO-分别具有还原性和氧化性,所以加入硫酸的试管,若存在SO32-、ClO-,分别生成了H2SO3和HClO;在A试管中滴加紫色石蕊试液,若先变红后退色,证明有ClO-,否则无;在B试管中滴加0.01mol L-1KMnO4溶液,若紫红色退去,证明有SO32-,否则无。
L-1KMnO4溶液,若紫红色退去,证明有SO32-,否则无。
答案:(1) Na2SO3+H2O;(2) Na2SO3;(3) ①SO32-、ClO-都存在
②

 w_w w. k#s5_
w_w w. k#s5_
|
实验步骤 |
预期现象和结论 |
步骤1:取少量吸收液于试管中,滴加3 moL L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中 L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中 |
 |
|
步骤2:在A试管中滴加紫色石蕊试液 |
若先变红后退色,证明有ClO-,否则无 |
步骤3:在B试管中滴加0.01mol L-1KMnO4溶液 L-1KMnO4溶液 |
若紫红色退去,证明有SO32-,否则无 |
 在容积不变的反应容器中,要求通过调节体系温度使A(g)+2B(g) 2C(g)达平衡时保持气体总物质的量为12 mol,现向反应容器中通入6.5 mol A、x mol B和2 mol C,欲使起始反应向逆反应方向移动,x的取值范围为__________2.5
< x < 3.5。
在容积不变的反应容器中,要求通过调节体系温度使A(g)+2B(g) 2C(g)达平衡时保持气体总物质的量为12 mol,现向反应容器中通入6.5 mol A、x mol B和2 mol C,欲使起始反应向逆反应方向移动,x的取值范围为__________2.5
< x < 3.5。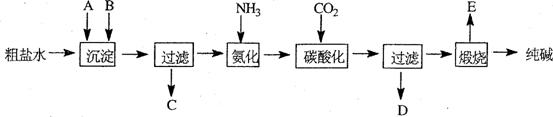

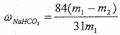 。
。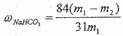 。
。