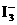1.原子核对核外电子的吸引力 2.形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(kJ/mol):
|
|
失去第一个电子 |
失去第二个电子 |
失去第三个电子 |
失去第四个电子 |
|
锂 |
519 |
7296 |
11799 |
|
|
X |
502 |
4570 |
6920 |
9550 |
|
Y |
580 |
1820 |
2750 |
11600 |
① 通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量。_____________________________________________
② 表中X可能为以上13种元素中的_____(填写字母)元素。用元素符号表示X和J形成化合物的化学式____
③ Y是周期表中_____族元素。
④ 以上13种元素中,_____(填写字母)元素原子失去核外第一个电子需要的能量最多。
23.钾是-种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反应为:
Na(l)+KCl(l) NaCl(l)+K(g)一Q
NaCl(l)+K(g)一Q
|
压强(kPa) |
K的沸点(℃) |
Na的沸点(℃) |
KCl的沸点(℃) |
NaCl的沸点(℃) |
|
13.33 |
590 |
700 |
|
|
|
53.32 |
710 |
830 |
|
|
|
101.3 |
770 |
890 |
1437 |
1465 |
该反应的平衡常数可表示为:K=c(K),各物质的沸点与压强的关系见上表。
(1)在常压下金属钾转变为气态从反应混合物中分离的最低温度约为__________,而反应的最高温度应低于__________
(2)在制取钾的过程中,为了提高原料的转化率可以采取的措施是_______________
|
23.在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为650 mg/L。现用氯氧化法处理,发生如下反应(其中N均为-3价):KCN+2KOH+Cl2¾®KOCN+2KCl+H2O。被氧化的元素是_____
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气。请配平下列化学方程式,并标出电子转移方向和数目:
___KOCN+___KOH+___Cl2¾®___CO2+___N2+___KCl+___H2O
(3)若处理上述废水20 L,使KCN完全转化为无毒物质,至少需液氯_____g。
|
 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表。
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表。
回答下列问题:
(1)该反应的化学平衡常数表达式为K=__________
(2)该反应为__________(填:吸热、放热)反应。
(3)能判断该反应是否达到化学平衡状态的依据是_____
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v正(H2)=v逆(H2O) (d)c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为_____℃。
24.某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
|
序号 |
时间 温度 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
|
2 |
800℃ |
C2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
3 |
800℃ |
C3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
4 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内,用A物质浓度的变化表示的平均速率为_____mol/(L·min)。
(2)在实验2,A的初始浓度C2=_____mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是__________________
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3_____V1(填:>、=、<),且C3_____1.0 mol/L(填:>、=、<)。
(4)比较实验4和实验1,可推测该反应是_____反应(填:吸热、放热)。理由是_______________
 2SO3(g)+Q(Q>0)
2SO3(g)+Q(Q>0)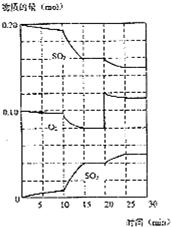 (2)如果该反应方程式中I2和KIO3的系数都是5
(2)如果该反应方程式中I2和KIO3的系数都是5