摘要:将主要成分与杂质成分极值化考虑.再与实际情况比较.就可判断出杂质的成分.2.将13.2 g可能混有下列物质的(NH4)2SO4样品.在加热条件下.与过量的NaOH反应.可收集到4.3 L.则样品中不可能含有的物质是 A.NH4HCO3.NH4NO3 B.(NH4)2CO3.NH4NO3 C.NH4HCO3.NH4Cl D.(NH4)2CO3.NH4Cl
网址:http://m.1010jiajiao.com/timu3_id_68295[举报]
闪锌矿(主要成份为ZnS)是含锌主要矿物之一,空气中高温加热闪锌矿生成ZnO和SO2.ZnO用于冶炼金属锌,SO2可制亚硫酸盐或硫酸.回答下列问题(以下计算保留2位小数)
(1)取1.56g闪锌矿样品,在空气中高温加热(杂质不反应),充分反应后,冷却,得到残留固体的质量为1.32g,样品中含硫化锌的质量分数是 .
(2)取1.95g锌加入到12.00mL18.4mol/L的浓硫酸中(反应中只生成一种还原产物),充分反应后,小心地将溶液稀释到1000mL,取出15.00mL,以酚酞为指示剂,用0.25mol/L的NaOH溶液中和余酸,耗用NaOH溶液的体积为21.70mL.
①反应后溶液中多余的硫酸是 mol.
②通过计算确定浓硫酸被还原的产物是 .
(3)将标况下4.48LSO2气体慢慢通入200mL一定浓度NaOH溶液中,SO2气体全部被吸收,将反应后的溶液在空气中小心蒸干(不考虑酸式盐的分解),得到不超过两种物质的无水晶体26.8g.通过计算确定所得晶体的成分与物质的量. 查看习题详情和答案>>
(1)取1.56g闪锌矿样品,在空气中高温加热(杂质不反应),充分反应后,冷却,得到残留固体的质量为1.32g,样品中含硫化锌的质量分数是
(2)取1.95g锌加入到12.00mL18.4mol/L的浓硫酸中(反应中只生成一种还原产物),充分反应后,小心地将溶液稀释到1000mL,取出15.00mL,以酚酞为指示剂,用0.25mol/L的NaOH溶液中和余酸,耗用NaOH溶液的体积为21.70mL.
①反应后溶液中多余的硫酸是
②通过计算确定浓硫酸被还原的产物是
(3)将标况下4.48LSO2气体慢慢通入200mL一定浓度NaOH溶液中,SO2气体全部被吸收,将反应后的溶液在空气中小心蒸干(不考虑酸式盐的分解),得到不超过两种物质的无水晶体26.8g.通过计算确定所得晶体的成分与物质的量. 查看习题详情和答案>>
(2007?南京二模)锶(Sr)位于元素周期表的第5周期ⅡA族.碳酸锶大量用于生产彩色电视显像管的荧光屏玻璃.工业上常以天青石(主要成分为硫酸锶,含不溶性杂质)为原料,采用以下两种方法制取碳酸锶,进而制得多种锶的化合物.
方法一:将天青石粉碎后在1 000℃~1 200℃时与碳在还原气氛中反应制得硫化锶.向硫化锶溶液中通入CO2得到碳酸锶.
方法二:将天青石粉末与碳酸钠溶液的混合物在90℃时加热1~2h,经过滤、洗涤,得到碳酸锶.
(1)方法一将天青石粉碎的目的是
写出用碳还原天青石反应的化学方程式:
(2)方法二的反应能够发生,说明
为了使该反应充分进行,还可以采取的措施是
(3)两种方法中得到的碳酸锶纯度较高的是
(4)下列关于锶及其化合物的叙述中,正确的是
A.离子半径:Ba2+>Sr2+>Ca2+>Be2+ B.碱性:Ba(OH)2>Sr(OH)2>Ca(OH)2
C.SrCO3高温分解可以制取SrO D.SrCO3与HNO3溶液反应可制取Sr(NO3)2.
查看习题详情和答案>>
方法一:将天青石粉碎后在1 000℃~1 200℃时与碳在还原气氛中反应制得硫化锶.向硫化锶溶液中通入CO2得到碳酸锶.
方法二:将天青石粉末与碳酸钠溶液的混合物在90℃时加热1~2h,经过滤、洗涤,得到碳酸锶.
(1)方法一将天青石粉碎的目的是
增加反应物接触面积,提高反应速率和原料的利用率
增加反应物接触面积,提高反应速率和原料的利用率
.写出用碳还原天青石反应的化学方程式:
4C+SrSO4
SrS+4CO↑
| ||
4C+SrSO4
SrS+4CO↑
.
| ||
(2)方法二的反应能够发生,说明
碳酸锶的溶解度小于硫酸锶的溶解度
碳酸锶的溶解度小于硫酸锶的溶解度
.为了使该反应充分进行,还可以采取的措施是
搅拌
搅拌
.(3)两种方法中得到的碳酸锶纯度较高的是
方法一
方法一
(填“方法一”或“方法二”),理由是硫化锶可溶于水,通过过滤可以除去不溶性杂质
硫化锶可溶于水,通过过滤可以除去不溶性杂质
.(4)下列关于锶及其化合物的叙述中,正确的是
ABCD
ABCD
.A.离子半径:Ba2+>Sr2+>Ca2+>Be2+ B.碱性:Ba(OH)2>Sr(OH)2>Ca(OH)2
C.SrCO3高温分解可以制取SrO D.SrCO3与HNO3溶液反应可制取Sr(NO3)2.
闪锌矿(主要成份为ZnS)是含锌主要矿物之一,高温加热闪锌矿生成ZnO和SO2.ZnO用于冶炼金属锌,SO2可制亚硫酸盐或硫酸.计算回答下列问题(保留2位小数):
(1)取1.56g闪锌矿样品,在空气中高温加热(杂质不反应),充分反应后,冷却,得到残留固体的质量为1.32g,样品中含硫化锌的质量分数是 .
(2)取1.95g锌加入到12.00mL 18.4mol/L的浓硫酸中(假设生成的气体中无氢气,浓硫酸产生单一的还原产物),充分反应后,小心地将溶液稀释到1000mL,取出15.00mL,以酚酞为指示剂,用0.25mol/L的NaOH溶液滴定,耗用NaOH溶液的体积为21.70mL.通过计算确定浓硫酸被还原的产物是 .
(3)若将ZnS溶于强酸可产生硫化氢气体.在120°C、1atm下,将100mL硫化氢和氧气的混合气体点燃,恢复到原来状态,测得剩余气体为70mL,求原混合气体中硫化氢的体积分数.(不考虑硫化氢气体自身受热分解)
(4)将标况下4.48L SO2气体慢慢通入200mL一定浓度NaOH溶液中,SO2气体全部被吸收,将反应后的溶液在空气中小心蒸干(不考虑酸式盐的分解),得到不超过两种物质的无水晶体26.8g.通过计算确定所得晶体的成分与物质的量. 查看习题详情和答案>>
(1)取1.56g闪锌矿样品,在空气中高温加热(杂质不反应),充分反应后,冷却,得到残留固体的质量为1.32g,样品中含硫化锌的质量分数是
(2)取1.95g锌加入到12.00mL 18.4mol/L的浓硫酸中(假设生成的气体中无氢气,浓硫酸产生单一的还原产物),充分反应后,小心地将溶液稀释到1000mL,取出15.00mL,以酚酞为指示剂,用0.25mol/L的NaOH溶液滴定,耗用NaOH溶液的体积为21.70mL.通过计算确定浓硫酸被还原的产物是
(3)若将ZnS溶于强酸可产生硫化氢气体.在120°C、1atm下,将100mL硫化氢和氧气的混合气体点燃,恢复到原来状态,测得剩余气体为70mL,求原混合气体中硫化氢的体积分数.(不考虑硫化氢气体自身受热分解)
(4)将标况下4.48L SO2气体慢慢通入200mL一定浓度NaOH溶液中,SO2气体全部被吸收,将反应后的溶液在空气中小心蒸干(不考虑酸式盐的分解),得到不超过两种物质的无水晶体26.8g.通过计算确定所得晶体的成分与物质的量. 查看习题详情和答案>>
(Ⅰ)实验室中盐酸的用途十分广泛,常常用来制备气体.
(1)某小组同学欲用4mol/L的盐酸配制230mL 0.4mol/L 盐酸溶液,需取用4mol/L盐酸
(2)下列实验操作使配制的溶液浓度偏低的是
A.容量瓶洗涤后未干燥
B.移液时,有少量溶液溅出
C.定容时,加水不慎超过刻度线,又倒出一些
D.定容时,俯视刻度线
E.装入试剂瓶时,有少量溶液溅出
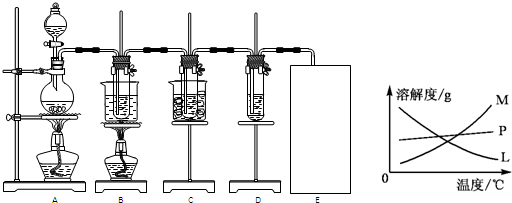
(Ⅱ)瑞典化学家舍勒将软锰矿(主要成分为MnO2)与浓盐酸混合加热,在世界上首先得到了氯气.已知Cl2和碱溶液在不同条件下,得到的产物不同,某兴趣小组用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质.( 3Cl2+6KOH
KClO3+5KCl+3H2O )图中:A为氯气发生装置;B的试管里盛有15mL 30% KOH溶液,并置于水浴中;C的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;D的试管里加有紫色石蕊试液.
请填写下列空白:
(1)制取氯气时,在圆底烧瓶里加入一定质量的二氧化锰,通过
(2)反应完毕经冷却后,B的试管中有大量晶体析出.图中符合该晶体溶解度曲线的是
(3)实验中可观察到D的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
(4)请在装置图方框中画出缺少的实验装置,并注明试剂.
查看习题详情和答案>>

(1)某小组同学欲用4mol/L的盐酸配制230mL 0.4mol/L 盐酸溶液,需取用4mol/L盐酸
25
25
mL,实验中需要用到的玻璃仪器有烧杯
烧杯
、250ml容量瓶
250ml容量瓶
、量筒、烧杯、胶头滴管.(2)下列实验操作使配制的溶液浓度偏低的是
BC
BC
A.容量瓶洗涤后未干燥
B.移液时,有少量溶液溅出
C.定容时,加水不慎超过刻度线,又倒出一些
D.定容时,俯视刻度线
E.装入试剂瓶时,有少量溶液溅出
(Ⅱ)瑞典化学家舍勒将软锰矿(主要成分为MnO2)与浓盐酸混合加热,在世界上首先得到了氯气.已知Cl2和碱溶液在不同条件下,得到的产物不同,某兴趣小组用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质.( 3Cl2+6KOH
| ||
请填写下列空白:
(1)制取氯气时,在圆底烧瓶里加入一定质量的二氧化锰,通过
分液漏斗
分液漏斗
(填仪器名称)向圆底烧瓶中加入适量的浓盐酸.装置A中反应的离子方程式MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
.
| ||
(2)反应完毕经冷却后,B的试管中有大量晶体析出.图中符合该晶体溶解度曲线的是
M
M
(填编号字母);从B的试管中分离出该晶体的方法是过滤
过滤
(填实验操作名称).该小组同学发现制得的氯酸钾产量偏低,可能的一种原因是Cl2中含有杂质,该杂质成分HCl
HCl
(除水蒸气外,填化学式),如何改进AB间增加一个盛有饱和氯化钠溶液吸收氯化氢的洗气装置
AB间增加一个盛有饱和氯化钠溶液吸收氯化氢的洗气装置
;(3)实验中可观察到D的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为 红 红 色 |
氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成的HClO将石蕊氧化为无色物质 氯气与水反应生成的HClO将石蕊氧化为无色物质 |
闪锌矿(主要成份为ZnS)是含锌主要矿物之一,高温加热闪锌矿生成ZnO和SO2。ZnO用于冶炼金属锌,SO2可制亚硫酸盐或硫酸。计算回答下列问题(保留2位小数)
(1)取1.56 g闪锌矿样品,在空气中高温加热(杂质不反应),充分反应后,冷却,得到残留固体的质量为1.32 g,样品中含硫化锌的质量分数是_________。
(2)取1.95 g锌加入到12.00 mL 18.4 mol/L的浓硫酸中(假设生成的气体中无氢气,浓硫酸产生单一的还原产物),充分反应后,小心地将溶液稀释到1000 mL,取出15.00 mL,以酚酞为指示剂,用0.25 mol/L的NaOH溶液滴定,耗用NaOH溶液的体积为21.70 mL。通过计算确定浓硫酸被还原的产物是________。
(3)若将ZnS溶于强酸可产生硫化氢气体。在120 oC、1 atm下,将100 mL硫化氢和氧气的混合气体点燃,恢复到原来状态,测得剩余气体为70 mL,求原混合气体中硫化氢的体积分数。(不考虑硫化氢气体自身受热分解)
(4)将标况下4.48 L SO2气体慢慢通入200 mL一定浓度NaOH溶液中,SO2气体全部被吸收,将反应后的溶液在空气中小心蒸干(不考虑酸式盐的分解),得到不超过两种物质的无水晶体26.8g。通过计算确定所得晶体的成分与物质的量。
查看习题详情和答案>>