12.(2010年江苏)对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。
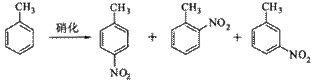
一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在CCl4溶液中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3溶液水洗至中性,再经分离提纯得到对硝基甲苯。
(l)上述实验中过滤的目的是 。
(2)滤液在分液漏斗中洗涤静置后,有机层处于 层(填“上”或“下”);放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有 。
(3) 下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
|
催化剂 |
n(催化剂) |
硝化产物中各种异构体质量分数(%) |
总产率(%) |
||
|
n(甲苯) |
对硝基甲苯 |
邻硝基甲苯 |
间硝基甲苯 |
||
|
浓H2SO4 |
1.0 |
35.6 |
60.2 |
4.2 |
98.0 |
|
1.2 |
36.5 |
59.5 |
4.0 |
99.8 |
|
|
NaHSO4 |
0.15 |
44.6 |
55.1 |
0.3 |
98.9 |
|
0.25 |
46.3 |
52.8 |
0.9 |
99.9 |
|
|
0.32 |
47.9 |
51.8 |
0.3 |
99.9 |
|
|
0.36 |
45.2 |
54.2 |
0.6 |
99.9 |
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为 。
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是 。
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有_ 、 。
解析:本题主要考察的是物质的性质和制备,同时考查了数据的处理与分析能力,能够迅速在表中提取到有用信息,利用信息解决有关问题的能力。
(1)因为NaHSO4在该反应中作为催化剂,而NaHSO4不溶于CCl4,所以此反应后过滤的目的是为了回收NaHSO4

 w_w w. k#s5_
w_w w. k#s5_
(2)因为该反应是以CCl4 作为有机溶剂的,CCl4的密度比水大,故有机层在下层;分液漏斗里的液体放不下来,除了分液漏斗堵塞,还有可能是分液漏斗上口活塞未打开,导致内外压强不相等。
(3)①从题给数据分析,当催化剂与甲苯的比例为0.32时,总产率最高且对硝基甲苯的含量最高 ②从题给数据可以看出,无论以何种比例反应,产物中的主要成分主要是对硝基甲苯和邻硝基甲苯; ③从题给数据可以看出,无论以何种比例反应,用NaHSO4 做催化剂的优点是在硝化产物中对硝基甲苯的比例提高、同时催化剂NaHSO4能循环使用。
答案:(1)回收NaHSO4
(2)下 分液漏斗上口塞子未打开
(3)①0.32
②甲苯硝化主要得到对硝基甲苯和邻硝基甲苯
③在硝化产物中对硝基甲苯比例提高 催化剂用量少且能循环使用(凡合理答案均可)
7.(2010年四川) 
 w_w w. k#s5_
w_w w. k#s5_
碘被称为“智力元素”,科学合理地补充碘可防止
 碘缺乏病。碘酸钾(KIO3)是国家规定的食盐加碘剂,
碘缺乏病。碘酸钾(KIO3)是国家规定的食盐加碘剂,
它的晶体为白色,可溶于水。碘酸钾在酸性介质中
与过氧化氢或碘化物作用均生成单质碘。以碘为原料,
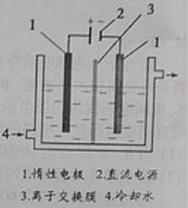
通过电解制备碘酸钾的实验装置如右图所示。
 请回答下列问题:
请回答下列问题:
(1)碘是 (填颜色)固体物质,实验室常用 方法来分离提纯含有少量杂质的固体碘。
(2)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:I2+6KOH=
5KI+KIO3+3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。电解时,阳极上发生反应的电极反应式为 ;
阴极上观察到的实验现象是 。
(3)电解过程中,为确定电解是否完成,需检验电解液中是否有I-。请设计一个检验电解
液中是否有I-的实验方案,并按要求填写下表。

 w_w w. k#s5_
w_w w. k#s5_
要求:所需药品只能从下列试剂中选择,实验仪器及相关用品自选。
试剂:淀粉溶液、碘化钾淀粉试纸、过氧化氢溶液、稀硫酸。

 w_w w. k#s5_
w_w w. k#s5_
|
实验方法 |
实验现象及结论 |
|
|
|
(4)电解完毕,从电解液中得到碘酸钾晶体的实验过程如下:
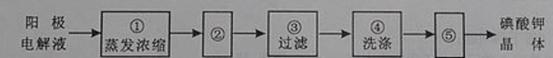
步骤②的操作名称是
,步骤⑤的操作名称是
。步骤④洗涤晶体的目的是
。

 w_w w. k#s5_
w_w w. k#s5_
解析:(1)考查物质的物理性质,较容易。碘是紫黑色固体易升华。(2)阳极发生氧化反应失电子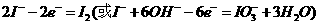 。阴极区加入氢氧化钾溶液,电解氢氧化钾实质是电解水,此时氢离子放电生成氢气,所以会有气泡产生。(3)考查I-的检验。此题可以借助与碘单质遇淀粉变蓝色这一特性,要设法将碘离子转化为碘单质。(4)考查实验的基本操作。要求考生对整个流程分析透彻。
。阴极区加入氢氧化钾溶液,电解氢氧化钾实质是电解水,此时氢离子放电生成氢气,所以会有气泡产生。(3)考查I-的检验。此题可以借助与碘单质遇淀粉变蓝色这一特性,要设法将碘离子转化为碘单质。(4)考查实验的基本操作。要求考生对整个流程分析透彻。
答案:(1)紫黑色 升华w w_w.k*s*5*
(2)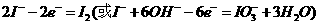 ;有气泡产生(3)
;有气泡产生(3)
|
实验方法 |
实验现象及结论 |
|
取少量阳极区电解液于试管中,加稀硫酸酸化后加入过氧化氢溶液,最后加入几滴淀粉试液,观察是否变蓝。 |
如果不变蓝,说明无I-。(如果变蓝,说明有I-。) |
(4)冷却结晶 干燥 洗去吸附在碘酸钾晶体上的氢氧化钾等杂质
5.(2010年安徽) 某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
[实验]制作银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
⑴下列有关制备银镜过程的说法正确的是 。
a. 边振荡盛有2%的AgNO3溶液的试管,边滴入2%的氨水,至最初的沉淀恰好溶解为止
b.将几滴银氨溶液滴入2ml乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性
e.在银氨溶液配置过程中,溶液的pH增大
[提出假设]
假设1:Fe3+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO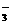 能氧化Ag。
能氧化Ag。
[设计实验方案,验证假设]
(2)甲同学从上述实验的生成物中检验出Fe2+,验证了假设1的成立。请写出Fe3+氧化Ag的离子方程式: 。
(3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示:NO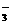 在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
|
实验步骤(不要求写具体操作过程) |
预期现象和结论 |
   w_w w. k#s5_ w_w w. k#s5_① ② 。。。。。。 |
若银镜消失,假设②成立。 若银镜不消失,假设②不成立。 |
[思考与交流]
⑷甲同学验证了假设1成立,若乙同学验证了假设2成立,则丙同学由此得出结论:Fe(NO3)3溶液中的Fe3+和NO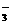 都氧化了Ag。
都氧化了Ag。
你是否同意丙同学的结论,并简述理由:________________________________。
解析:(1)发生银镜反应时银氨溶液应该是过量的,b错误;银镜反应需要水浴加热,c错误。因此ade正确;(2)依据反应的现象可以写出反应的化学方程式:Fe3+ + Ag = Fe2+ + Ag+;(3)NO3-只有在酸性条件下才具有氧化性,因此首先要测定溶液的pH,然后在配制相同pH的硝酸溶液进行反应;(4)见答案。
答案:(1)a、d、e (2)Fe3+ + Ag = Fe2+ + Ag+
(3)
|
实验步骤(不要求写具体操作过程) |
预期现象和结论 |
|
①测定上述实验用的Fe(NO3)3溶液的pH ②配制相同pH的硝酸溶液,将此溶液加入有银镜的试管内 |
若银镜消失,假设②成立。 若银镜不消失,假设②不成立。 |
(4)不同意。甲同学检验出了Fe2+,可确定Fe3+ 一定氧化了Ag;乙同学虽然验证了此条件下NO3-能氧化Ag,但在硝酸铁溶液氧化Ag时,由于没有检验NO3-的还原产物,因此不能确定NO3-氧化了Ag。[(3)(4)其他合理答案均可]
 (2010年浙江)一水硫酸四氨合铜(Ⅱ)的化学式为[Cu(NH3)4]SO4·H2O是一种重要的染料及农药中间体。某学习小组在实验室以氧化铜为主要原料合成该物质,设计的合成路线为:
(2010年浙江)一水硫酸四氨合铜(Ⅱ)的化学式为[Cu(NH3)4]SO4·H2O是一种重要的染料及农药中间体。某学习小组在实验室以氧化铜为主要原料合成该物质,设计的合成路线为: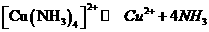






 TiO2·xH2O+4HCl。
TiO2·xH2O+4HCl。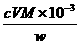 。
。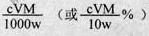
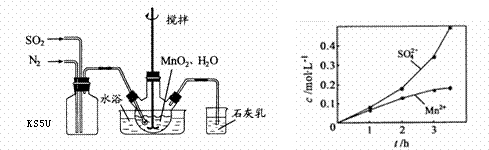
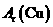 (近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H20),由此计算
(近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H20),由此计算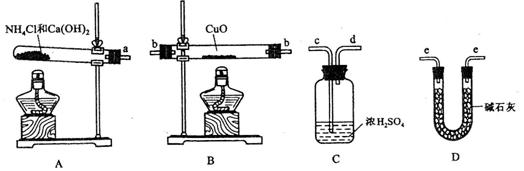
 3Cu+3H2O+N2↑;因为需要测定反应后生成物水的质量,所以必需保证通入的氨气是纯净干燥的,由于浓硫酸可以与氨气反应,因此只能通过碱石灰进行干燥,所以正确的顺序为a→e→b→e;根据反应方程式可知氧化铜和水的物质的量相等,所以有以下关系式:
3Cu+3H2O+N2↑;因为需要测定反应后生成物水的质量,所以必需保证通入的氨气是纯净干燥的,由于浓硫酸可以与氨气反应,因此只能通过碱石灰进行干燥,所以正确的顺序为a→e→b→e;根据反应方程式可知氧化铜和水的物质的量相等,所以有以下关系式: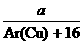 =
=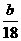 ,解得Ar(Cu)=
,解得Ar(Cu)=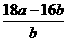 =
=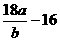 ;若Cu0未完全起反应,说明b偏小,结果偏大;若CuO不干燥,说明a偏小,b偏大,结果偏低;若Cu0中混有不反应的杂质,说明b偏小,结果偏大;若碱石灰不干燥,说明氨气干燥不彻底,b偏大,结果偏低;若NH4C1与Ca(OH)2混合物不干燥,但只要氨气干燥彻底,对结果不影响。所以选项①③正确;根据反应方程式可知也可以通过测定m(CuO)和m(Cu)或m(Cu)和m(H2O)来达到实验目的。
;若Cu0未完全起反应,说明b偏小,结果偏大;若CuO不干燥,说明a偏小,b偏大,结果偏低;若Cu0中混有不反应的杂质,说明b偏小,结果偏大;若碱石灰不干燥,说明氨气干燥不彻底,b偏大,结果偏低;若NH4C1与Ca(OH)2混合物不干燥,但只要氨气干燥彻底,对结果不影响。所以选项①③正确;根据反应方程式可知也可以通过测定m(CuO)和m(Cu)或m(Cu)和m(H2O)来达到实验目的。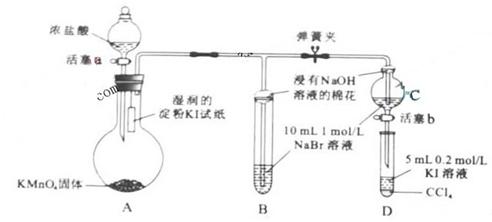 (2010年北京)为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行试验(夹持仪器已略去,气密性已检验)。
(2010年北京)为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行试验(夹持仪器已略去,气密性已检验)。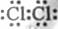 。(2)当碘离子被氧化成碘单质后,可以根据碘单质的性质:碘遇淀粉变蓝来证明。(3)B中的溶液变为黄色,说明有单质溴生成,反应的离子方程式是:
。(2)当碘离子被氧化成碘单质后,可以根据碘单质的性质:碘遇淀粉变蓝来证明。(3)B中的溶液变为黄色,说明有单质溴生成,反应的离子方程式是: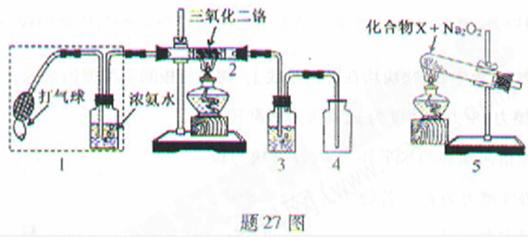
 4NO+6H2O。(2)停止加热后仍能保持红热,说明该反应为放热,因此不加热后仍能保持红热状态。(3)产物中有NO和没有反应的NH3,NO会被O2氧化生成NO2,NO2与空气中的水蒸气反应生成HNO3,而HNO3与NH3反应会产生白烟,因此必需除去未反应的NH3,可以用浓硫酸吸收NH3。(4)装置5与1均产生可以产生NH3。NH4Cl加热分解可得NH3和HCl,而HCl与Na2O2可生成O2。
4NO+6H2O。(2)停止加热后仍能保持红热,说明该反应为放热,因此不加热后仍能保持红热状态。(3)产物中有NO和没有反应的NH3,NO会被O2氧化生成NO2,NO2与空气中的水蒸气反应生成HNO3,而HNO3与NH3反应会产生白烟,因此必需除去未反应的NH3,可以用浓硫酸吸收NH3。(4)装置5与1均产生可以产生NH3。NH4Cl加热分解可得NH3和HCl,而HCl与Na2O2可生成O2。