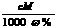7.元素周期律和周期表
(1)掌握元素周期律的实质,了解元素周期表(长式)的结构(周期、族)及其应用。(2)以第3周期为例,掌握同一周期内元素性质(如:原子半径、化合价、单质及化合物性质)的递变规律与原子结构的关系;以IA和ⅦA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
例7-1.下列各选项所述的两个量,前者一定大于后者的是( D )
①HF和HBr的沸点;②纯水在25℃和80℃时的pH;③同温下分别在100g水中最多能溶解的无水CuSO5和CuSO5·5H2O的质量;④25℃时,等体积的pH都等于3的盐酸和AlCl3溶液中,已电离的水分子数;⑤在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数;⑥耐火材料MgO和CaO的熔点;⑦H-和H+离子半径;⑧金刚石晶体和石墨晶体中,每个最小碳环里所含的实际碳原子数
A.①②④⑥ B.①②③⑤ C.⑤⑥⑦⑧ D.①②⑥⑦
例7-2.下表中的实线表示元素周期表的部分边界。①-⑥分别表示元素周期表中对应位置的元素。
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
③ |
④ |
|
|
|
① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
⑤ |
⑥ |
|
|
② |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
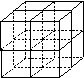 (1)请在上表中用实线补全元素周期表边界,并在对应部位标出主族符号。
(1)请在上表中用实线补全元素周期表边界,并在对应部位标出主族符号。
(2)元素③氢化物的电子式为 ,其空间构型为 。
(3)元素④的氢化物沸点比元素⑤的氢化物沸点 (填“高”或“低”)。
(4)元素①和元素⑥形成的化合物是 晶体(填晶体类型),右图为该晶体的结构示意图,请在图中用实心球(●)和空心球(○)分别表示元素①和元素⑥所在位置。
(5)元素①②形成的合金通常情况下呈 态,可作为 。
 答案:(1)略;(2)
答案:(1)略;(2)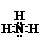 ,三角锥形;(3)高;
,三角锥形;(3)高;
(4)离子晶体,结构图;
(5)液态,原子反应堆的导热剂
20.一定条件下将质量为Xg的有机物在O2中完全燃烧,燃烧后全部产物通过足量Na2O2层,过氧化钠的质量增重Yg,下列对应关系一定不正确的是
|
序号 |
有机物 |
X |
Y |
|
A |
C2H4和C3H6的混合物 |
m |
15m/7 |
|
B |
HCOOH |
m |
m |
|
C |
CH3OH 和CH3COOH的混合物 |
m |
m |
|
D |
CH3COOCH3 |
m |
45m/37 |
19.含8.0g NaOH的溶液中通入一定量H2S后,将得到的溶液小心蒸干,称得无水物7.9g,则该无水物中一定含有的物质是
A.NaOH和Na2S B.Na2S和NaHS C.NaHS D.Na2S
 H++A2-;则NaHA溶液中:c(Na+)
= c(A2-)+c(HA-)+c(H2A)
H++A2-;则NaHA溶液中:c(Na+)
= c(A2-)+c(HA-)+c(H2A) Na2S4+3NaBr,电池中的左右两侧为电极,中间为离子选择性膜(在电池放电和充电时该膜允许钠离子通过);放电前,被膜隔开的电解质为Na2S2和NaBr3,放电后,分别变为Na2S4和NaBr。下列说法正确的是( BD
)
Na2S4+3NaBr,电池中的左右两侧为电极,中间为离子选择性膜(在电池放电和充电时该膜允许钠离子通过);放电前,被膜隔开的电解质为Na2S2和NaBr3,放电后,分别变为Na2S4和NaBr。下列说法正确的是( BD
)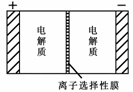 A.充电过程中,Na+ 离子的流向为从右到左
A.充电过程中,Na+ 离子的流向为从右到左
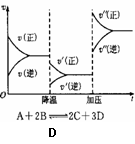
 A.②④⑥ B.③④⑥
C.①④⑥
D.①③⑥
A.②④⑥ B.③④⑥
C.①④⑥
D.①③⑥ N放出942kJ热量。根据以上信息和数据,下列说法正确的是( BC )
N放出942kJ热量。根据以上信息和数据,下列说法正确的是( BC )
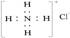 D.氟原子结构示意图:
D.氟原子结构示意图:
 Na++H++SO42-;
Na++H++SO42-; 例3-1.用NA表示阿伏加德罗常数,下列说法正确的是( B )
例3-1.用NA表示阿伏加德罗常数,下列说法正确的是( B ) B.物质的量浓度C可表示为:
B.物质的量浓度C可表示为: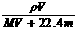
 D.溶液密度ρ可表示为:
D.溶液密度ρ可表示为: