9、在实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、
氨和二氧化碳反应,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:
NH3+CO2+NaCl+H2O NH4Cl+NaHCO3(晶体)依据此原理,欲制得碳酸钠晶体,某校
学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯
 化钠的溶液,且二者均已
化钠的溶液,且二者均已
达到饱和:
(1)A装置中所发生反应的离子方程式为 。
C装置中稀硫酸的作用为 。
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
 温度 温度溶 解 盐 度 |
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
|
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
|
NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
|
NH4Cl |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
参照表中数据,请分析B装置中使用冰水是因为 。
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在 装置之间(填写字母)连接一个盛有 的洗气装置,其作用是 。
(4)利用改进后的装置进行实验,在B中的试管内析出了晶体,经必要的操作后得
到了一种纯净的晶体。现有下列试剂:盐酸、浓氨水、生石灰、蒸馏水,利用本题所提供的
试剂(只限一种)及试管、酒精灯等主要仪器,通过简单实验判断该晶体是碳酸氢钠晶体,
而不是碳酸氢铵或食盐晶体,简述操作方法、实验现象及结论:
。
(5)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到
干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为 。
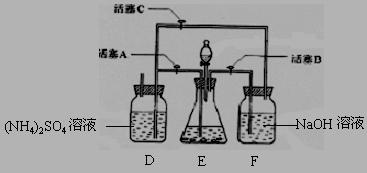
7、已知有一白色粉末是由NaCl、Na2SO4、Na2CO3、CuSO4、MgCl2中的一种或几种组成。某同学欲探究这一粉末的组成,做了如下实验:
①取少量粉末,加水溶解,得无色透明溶液;
②取①中溶液少量,加入NaOH溶液,无明显现象发生;
③另取少量粉末,加入稀盐酸,无明显现象发生。
(1)请你根据该同学实验所得现象,推测这一粉末的可能组成是 __;
(2)若推测该粉末只由Na2SO4组成,请你在该同学实验基础上设计后续实验,以确定这包粉末的组成。[可供选择的试剂有:BaCl2溶液、AgNO3溶液、稀HNO3、NaOH溶液、Na2CO3溶液、Ba(NO3)2溶液、稀盐酸]
|
实验步骤 |
实验现象 |
反应离子方程式和结论 |
|
④ |
|
|
注:实验步骤的序号由你按顺序编号。实验现象、离子方程式和结论要与相应的实验步骤一一对应。
 ,在该反应中____________做氧化剂,若消耗了
,在该反应中____________做氧化剂,若消耗了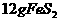 有_______________mol电子发生了转移;
有_______________mol电子发生了转移;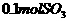 ,可放出
,可放出 的热量,请写出该反应的热化学方程式__________________________________________;
的热量,请写出该反应的热化学方程式__________________________________________;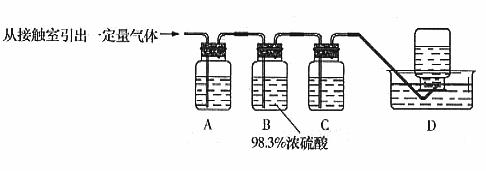
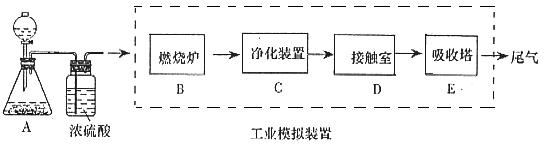
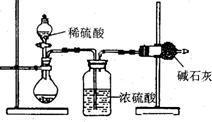 一般测定样品中成分含量的实验应重复二至三次。为了测定某氢氧化钠固体中混有的碳酸钠的质量分数,甲、乙两位同学分别设计了如下实验方案:
一般测定样品中成分含量的实验应重复二至三次。为了测定某氢氧化钠固体中混有的碳酸钠的质量分数,甲、乙两位同学分别设计了如下实验方案: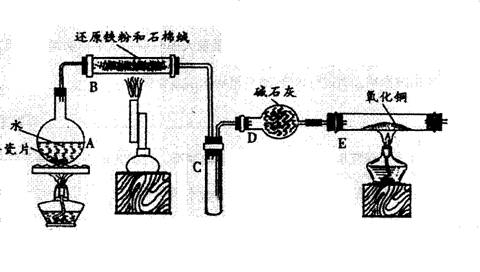 (1)装置B中发生反应的化学方程式是_________________________ ______;
(1)装置B中发生反应的化学方程式是_________________________ ______;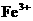 离子,你认为滤液中不含有
离子,你认为滤液中不含有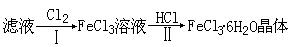
 ⑦燃烧匙 ⑧温度计 ⑨干燥管
⑦燃烧匙 ⑧温度计 ⑨干燥管

 水
水

