17.(15分)红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中也用作氧化剂,应用领域十分广泛。
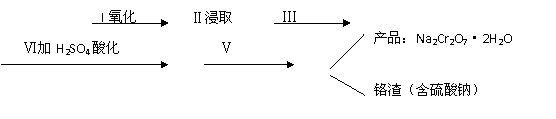
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)利用以下过程来制取。
 铬铁矿等原料
Na2CrO4溶液
铬铁矿等原料
Na2CrO4溶液
①步骤I中反应的化学方程式为:
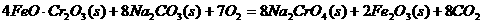 该反应的化学平衡常数的表达式为
,在常温下该反应速度极慢,下列措施中能使反应速率增大的是 。
该反应的化学平衡常数的表达式为
,在常温下该反应速度极慢,下列措施中能使反应速率增大的是 。
A.升高温度 B.通入过量的空气 C.将原料粉碎 D.增加纯碱的用量
②步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是 、 。
③步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是 。
④步骤Ⅳ中发生反应的离子方程式为: 。
(2)将红矾钠与KCl固体1:2(物质的量比)混合溶于水后经适当操作可得到K2Cr2O7晶体。请填写表中空格。完成上述过程。
|
序号 |
实验步骤 |
简述实验操作(不必叙述如何组装实验装置) |
|
① |
溶解 |
将混合物放入烧杯中,加水,充分搅拌直到固体不再溶解。 |
|
② |
|
|
|
③ |
|
|
|
④ |
|
|
|
⑤ |
过滤、干燥 |
得到K2Cr2O7晶体 |
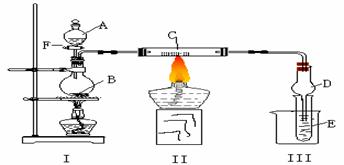
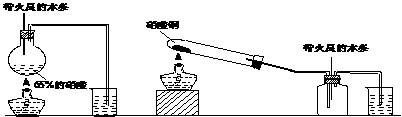
 CuO+SO2↑+SO3↑+O2↑,便决定设计一验证性实验探索测定反应产生的SO2、SO3和O2的物质的量,并经计算以此确定该条件下CuSO4分解反应方程式中各物质的化学计量数。实验可能用到的仪器如下图所示:
CuO+SO2↑+SO3↑+O2↑,便决定设计一验证性实验探索测定反应产生的SO2、SO3和O2的物质的量,并经计算以此确定该条件下CuSO4分解反应方程式中各物质的化学计量数。实验可能用到的仪器如下图所示: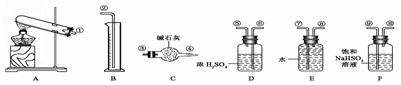
 使平衡向左移动
使平衡向左移动 使平衡向左移动
使平衡向左移动
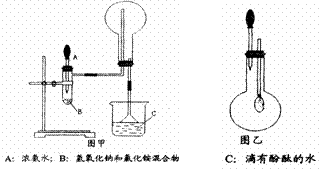
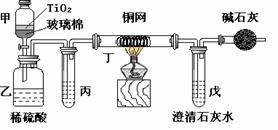 (15分)电镀厂曾采用有氰电镀工艺,处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率。
(15分)电镀厂曾采用有氰电镀工艺,处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率。 (11分)铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶 于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
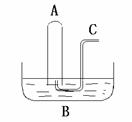
(11分)铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶 于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验: