29、(12分)某种胃药的止酸剂为碳酸钙,测定每片药中碳酸钙含量的方法有以下几个步骤操作(设药片中的其他成分不与盐酸、氢氧化钠 反应):
①配制0.10mol/L稀盐酸和0.10mol/L的氢氧化钠溶液
②取一粒药片(药片质量相同均为0.1g),研磨后加入20.0ml蒸馏水,
③以酚酞作指示剂,用0.10mol/L氢氧化钠溶液滴定,用去体积为V升时达
到终点。
④加入25ml0.10mol/L稀盐酸请回答下列问题:
(1)测定过程中的正确操作顺序是_________________(填序号)
(2)测定过程中发生的离子反应方程式是:_______________ _____________,



 (3)下列所示的仪器中,在配制稀盐酸和氢氧化钠溶液时一定不需要的是________________________
(3)下列所示的仪器中,在配制稀盐酸和氢氧化钠溶液时一定不需要的是________________________
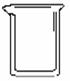

A B C D E F
(4) 某同学四次测定的V数据如下:
|
测定次序 |
第一次 |
第二次 |
第三次 |
第四次 |
|
V/ml |
12.9 |
15.4 |
13.1 |
13.0 |
根据该同学的实验数据,计算药片中的碳酸钙的质量分数为_______________
(5) 若为减小误差,该实验需要滴定4次,实验室现有50ml,100ml,250ml,500ml规格的容量瓶,配制本实验用稀盐酸应选用的容量瓶规格最好为_________ml
27、(14分)10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
|
温度(℃) |
10 |
20 |
30 |
加热煮沸后冷却到50℃ |
|
pH |
8.3 |
8.4 |
8.5 |
8.8 |
甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为 。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度 (填“大于”或“小于”)NaHCO3。丙同学认为甲、乙的判断都不充分。丙认为:
⑴只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则 (填“甲”或“乙”)判断正确。试剂X是 。
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清的石灰水
⑵将加热后的溶液冷却到10℃,若溶液的pH (填“高于”、“低于”或“等于”)8.3,则 (填“甲”或“乙”)判断正确。
⑶查阅资料,发现NaHCO3的分解温度为150℃,丙断言 (填“甲”或“乙”)判断是错误的,理由是 。
 H2CO3+OH-;大于; ⑴ 乙 ; B;
H2CO3+OH-;大于; ⑴ 乙 ; B; 阴 负 2H+ + 2e→H2 ↑ = > 2Cl-+ 2H2O 2OH-
+Cl2 ↑+ H2↑ 24.OH-、K+、Cl-;铁粉;Ag;Ag+、Cl-、Fe3+、OH-;KNO3
阴 负 2H+ + 2e→H2 ↑ = > 2Cl-+ 2H2O 2OH-
+Cl2 ↑+ H2↑ 24.OH-、K+、Cl-;铁粉;Ag;Ag+、Cl-、Fe3+、OH-;KNO3