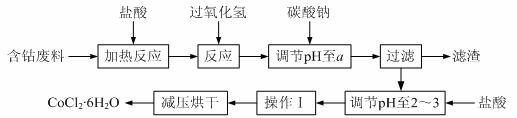
6.(12分)CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图:
已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
|
沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
|
开始沉淀 |
2.3 |
7.5 |
7.6 |
3.4 |
|
完全沉淀 |
4.1 |
9.7 |
9.2 |
5.2 |
请回答下列问题:
⑴在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为 ▲ 。
⑵加入碳酸钠调节pH至a,a的范围是 ▲ 。
⑶操作Ⅰ包含3个基本实验操作,它们是 ▲ 和过滤。
⑷制得的CoCl2·6H2O需减压烘干的原因是 ▲ 。
⑸为测定产品中CoCl2·6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是 ▲ 。
⑹在实验室中,为了从上述产品中获得纯净的CoCl2·6H2O,采用的方法是 ▲ 。
4.(10分)随着工业的迅速发展,产生的废水对水体的污染也日趋严重。通过控制溶液的pH对工业废水中的金属离子进行分离是实际工作中经常使用的方法。下表是常温下金属氢氧化物的Ksp(沉淀溶解平衡常数)和金属离子在某浓度下开始沉淀所需的pH(表中浓度为相应pH时溶液中有关金属离子产生沉淀的最小浓度;当溶液中金属离子浓度小于10-5 mol·L-1时通常认为该离子沉淀完全)。
|
金属离子 |
Ksp |
pH(10-1mol·L-l) |
pH(10-5mol·L-l) |
|
Fe3+ |
4.0×10-38 |
2.7 |
3.7 |
|
Cr3+ |
6.0×10-31 |
4.3 |
5.6 |
|
Cu2+ |
2.2×10-20 |
4.7 |
6.7 |
|
Ca2+ |
4.0×10-5 |
12.3 |
14.3 |
(1)某厂排出的废水中含有Cu2+和Fe3+,测得其浓度均小于0.1 mol·L-l。为除去其中的Fe3+,回收铜,需控制的pH范围是__________________________。
(2)为了处理含有Cr2O72-酸性溶液的工业废水,采用如下方法:向废水中加人适量NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准。
 ①Cr2O72-转变为Cr3+的离子方程式为_______________________________。
①Cr2O72-转变为Cr3+的离子方程式为_______________________________。
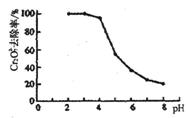
②pH对废水中Cr2072-去除率的影响如右图。你认为电解过程中溶液的pH取值在______范围内对降低废水中的铬含量最有利,请说明理由:____________________________________________。
[注:去除率(%)=[(c0-c)/co]×100%,
式中:co-理前废水中Cr2O72-的浓度, c-处理后废水中Cr2O72-的浓度]
(3)沉淀转化在生产中也有重要应用。例如,用Na2C03溶液可
以将锅炉水垢中的CaS04转化为较疏松而易清除的CaC03,该沉淀转化达到平衡时,其平衡常数K=_________(写数值)。[已知Ksp (CaS04)=9.1x10-6,Ksp (CaC03)=2.8x10-9]
3.(10分)近期因“召回门”而闹的沸沸扬扬的丰田Prius属第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态。
(1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,每生成1 mol水蒸气放热569.1 kJ。则该反应的热化学方程式为_________________________________。
 (2)混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解液。镍氢电池充放电原理示意如图,其总反应式是:
(2)混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解液。镍氢电池充放电原理示意如图,其总反应式是:

根据所给信息判断,混合动力车上坡或加速时,乙电极周围
溶液的pH将_______(填“增大”、“不变”或“减小”),该
电极的电极反应式为_________________。
(3)汽车尾气中的一氧化碳是大气污染物,可通过如下反应降低其浓度:
CO(g)+1/2O2(g)  CO2(g)。
CO2(g)。
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示。请填写表中的空格。
|
容器编号 |
c(CO)/mo1·L-1 |
c (02)/mol·L-1 |
c (C02)/mol·L-1 |
v(正)和v (逆) 比较 |
|
I |
2.0×10-4 |
4.0×10-4 |
4.0×10-2 |
v(正)=v(逆) |
|
Ⅱ |
3.0×10-4 |
4.0×10-4 |
5.0×10-2 |
|
②相同温度下,某汽车尾气中CO、CO2的浓度分别为1.0×10-5mol·L-l和1.0×10-4mol·L-l。若在汽车的排气管上增加一个补燃器,不断补充O2并使其浓度保持为1.0×10-4mol·L-1,则最终尾气中C0的浓度为_________mol·L-1。
1.2009年10月1日,我国成功举办国庆六十年阅兵活动。其中阅兵仪式上9辆电 动车与混合动力车等新能源车辆的亮相,展示了综合国力、国防科技发展水平。同时也说明能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
动车与混合动力车等新能源车辆的亮相,展示了综合国力、国防科技发展水平。同时也说明能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合 成甲醇:
成甲醇:
反应Ⅰ: CO(g) + 2H2(g)  CH3OH(g)
ΔH1
CH3OH(g)
ΔH1
反应Ⅱ: CO2(g) + 3H2(g)  CH3OH(g) +
H2O(g)
CH3OH(g) +
H2O(g)  ΔH2
ΔH2
① 上述反应符合“原子经济”原则的是 _____(填“Ⅰ”或“Ⅱ”)。
② 下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
|
温度[ |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
③ 某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1 = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2 = -566.0 kJ/mol
③  H2O(g) = H2O(l) ΔH3 = -44.0 kJ/mol
H2O(g) = H2O(l) ΔH3 = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
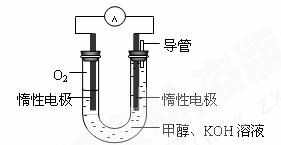 (3)某实验小组依据甲醇燃烧的反应原理,
(3)某实验小组依据甲醇燃烧的反应原理,
①设计如图所示的电池装置。该电池正极的电极反应为 。
② 工作一段时间后,测得溶液的pH减小,
该电池总反应的化学方程式为 。
 可通过多种途径转化成FeCl
可通过多种途径转化成FeCl 。(1)在FeCl
。(1)在FeCl H
H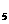 Cl),在130℃持续加热约3小时,可发生如下反应:
Cl),在130℃持续加热约3小时,可发生如下反应: 2 FeCl
2 FeCl + C
+ C Cl
Cl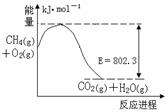 反过来加剧全球变暖。
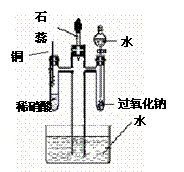
反过来加剧全球变暖。 (2)美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的电池,氢气虽然使用方便,却受到价格和来源的限制。常用的燃料往往是某些碳氢化合物,如甲烷(天然气)、汽油等。电池的构造如图所示:两个电极均由多孔碳制成,通入的气体由孔隙中流出,并从电极表面放出。
(2)美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的电池,氢气虽然使用方便,却受到价格和来源的限制。常用的燃料往往是某些碳氢化合物,如甲烷(天然气)、汽油等。电池的构造如图所示:两个电极均由多孔碳制成,通入的气体由孔隙中流出,并从电极表面放出。

 17(附加题).(15分) 为了证明NO可以与O2和H2O共同反应生成HNO3,某学生设计了以下装置按如下实验步骤进行实验
17(附加题).(15分) 为了证明NO可以与O2和H2O共同反应生成HNO3,某学生设计了以下装置按如下实验步骤进行实验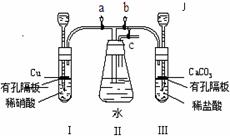
 、I
、I 的氧化性强弱,进行了如下实验。
的氧化性强弱,进行了如下实验。 , 振荡后静置,观察到下层液体呈紫红色;
, 振荡后静置,观察到下层液体呈紫红色; >Br
>Br 溶液 ②碘水 ③KI溶液 ④稀H
溶液 ②碘水 ③KI溶液 ④稀H 装置是验证氯化铵受热产生的气体是
装置是验证氯化铵受热产生的气体是