19.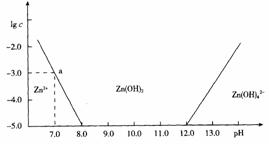 (10分)如图:横坐标为溶液的pH值,
(10分)如图:横坐标为溶液的pH值,
纵坐标为Zn2+离子或Zn(OH)42–离子物
质的量溶液的对数,回答下列问题。
(1)往ZnCl2溶液中加入足量的氢氧
化钠溶液,反应的离子方程式可
表示为:
。
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=
(3)某废液中含Zn2+离子,为提取Zn2+离子可以控制溶液中pH值的范围是
(4)往1L 1.00mol·L-1 ZnCl2溶液中加入NaOH固体至pH=6,需NaOH mol(精确至小数点后2位)
(5)25℃时,PbCl2固体在盐酸中的溶解度如下:
|
c(HCl)/(mol·L–1) |
0.50 |
1.00 |
2.04 |
2.90 |
4.02 |
5.16 |
5.78 |
|
c (PbCl2)/( 10–3mol·L–1) |
5.10 |
4.91 |
5.21 |
5.90 |
7.48 |
10.81 |
14.01 |
根据上表数据判断下列说法正确的是
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
B.PbCl2固体在0.50 mol·L-1盐酸中的溶解度小于在纯水中的溶解度
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子)
D.PbCl2固体可溶于饱和食盐水
18.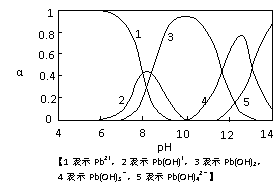 (8分)水体中重金属铅的污染方向问题
(8分)水体中重金属铅的污染方向问题
备受关注。水溶液中铅的存在形态主要
有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)-、
Pb(OH)42-,各形态的浓度分数α随溶液
pH变化的关系如图所示:
(1)Pb(NO3)2溶液中,c(NO3-)/c(Pb2+)
2(填“>”、“=”、“<”=);
往该溶液中滴入氯化铵溶液后,
c(NO3-)/c(Pb2+)增加,可能的原因
是 。
(2)往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液中存在的阳离子(Na+除外)有 ,pH=9时主要反应的离子方程式为 。
(3)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
|
离子 |
Pb2+ |
Cu2+ |
Fe3+ |
Mn2+ |
Cl- |
|
处理前浓度/(mol·L-1) |
0.100 |
29.8 |
0.120 |
0.087 |
51.9 |
|
处理后浓度/(mol·L-1) |
0.004 |
22.6 |
0.040 |
0.053 |
49.8 |
上表中除Pb2+外,该脱铅剂对其它离子的去除效果最好的是
。(4)如果该脱铅剂(用EH)脱铅过程中主要发生的反应为:2EH(s)+Pb2+ E2Pb(s)+2H+
E2Pb(s)+2H+
则脱铅的最合适pH范围为 (填代号)。
A 4-5 B 6-7 C 9-10 D 11-12
 NH3·H2O+H3O+ B.HCO3-+ H2O
NH3·H2O+H3O+ B.HCO3-+ H2O
 (10分)羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材 料,其常用的制备方法有两种:
(10分)羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材 料,其常用的制备方法有两种: