18.(10分)下表所列数据是在某高温下金属镁和镍分别在氧气中 进行氧化反应时,在金属表面生成氧化薄膜的实验记录:(注:a和b均为与温度有关的常数。)
|
反应时间t/h |
1 |
4 |
9 |
16 |
25 |
|
MgO层厚Y/nm |
0.05a |
0.20a |
0.45a |
0.80a |
1.25a |
|
NiO层厚Y ’/nm |
b |
2b |
3b |
4b |
5b |
(1)金属高温氧化腐蚀速率可用金属氧化膜的生长速率来表示,其理由是
。
(2)金属氧化膜的膜厚Y跟时间t所呈现的关系是Y = ,Y ’ = ;MgO氧化膜膜厚Y属 型,NiO氧化膜膜厚Y ’属 型(填“直线”或“抛物线”,“对数”或“双曲线”等类型)。
(3)Mg与Ni相比较,金属 具有更良好的耐高温氧化腐蚀性,其理由是 。
16.(8分)“碘钟”实验中,3I-+S2O82-=I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
c(I-)/mol·L-1 |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
|
c(S2O82-)/mol·L-1 |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
|
t /s |
88.0 |
44.0 |
22.0 |
44.0 |
t2 |
回答下列问题:
(1)该实验的目的是 。
(2)显色时间t2= 。
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为 (填字母)
A.<22.0s B.22.0-44.0s C.>44.0s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是 。
14.(9分)下表是稀硫酸与某金属反应的实验数据:
|
实验
序号 |
金属
质量/g |
金属
状态 |
c(H2SO4)
/mol·L-1 |
V(H2SO4)
/mL |
溶液温度/℃ |
金属消失
的时间/s |
|
|
反应前 |
反应后 |
||||||
|
1 |
0.10 |
丝 |
0.5 |
50 |
20 |
34 |
500 |
|
2 |
0.10 |
粉末 |
0.5 |
50 |
20 |
35 |
50 |
|
3 |
0.10 |
丝 |
0.7 |
50 |
20 |
36 |
250 |
|
4 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 |
|
5 |
0.10 |
粉末 |
0.8 |
50 |
20 |
36 |
25 |
|
6 |
0.10 |
丝 |
1.0 |
50 |
20 |
35 |
125 |
|
7 |
0.10 |
丝 |
1.0 |
50 |
35 |
50 |
50 |
|
8 |
0.10 |
丝 |
1.1 |
50 |
20 |
34 |
100 |
|
9 |
0.10 |
丝 |
1.1 |
50 |
35 |
54 |
40 |
分析上述数据,回答下列问题:
(1)实验4和5表明, 对反应速率有影响,
反应速率越快;能表明同一规律的实验还有 (填序号)。
(2)仅表明反应物浓度对反应速率产生影响的实验有 (填序号)。
(3)本实验中影响反应速率的其他因素还有 ,其实验序号是 。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因: 。
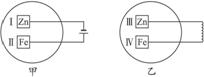
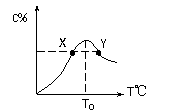 (9分)将物质的量均为3.00mol物质A、B混合于5L溶器中,发生如下反应 3A+B
(9分)将物质的量均为3.00mol物质A、B混合于5L溶器中,发生如下反应 3A+B 2C,在反应过程中C的物质的量分数随温度变化如图所示:
2C,在反应过程中C的物质的量分数随温度变化如图所示: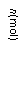
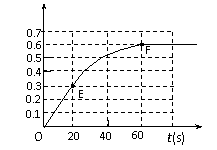 (8分)373K时,某1L密闭容器中发生如下可逆反应:A(g)
(8分)373K时,某1L密闭容器中发生如下可逆反应:A(g) 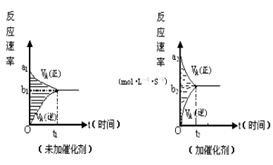 则其v-t图像如下右图。
则其v-t图像如下右图。