14.(2009理综全国卷I,11)(6分)为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1 g样品加热,其质量变为w2 g,则该样品的纯度(质量分数)是( )
A.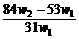 B.
B. C.
C. D.
D.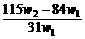
高考真题答案与解析
化 学
[考点14]钠及其化合物
|
Fe(OH)3、CaCO3。
(2)“趁热过滤”的原因是使析出的晶体为Na2CO3·H2O,防止因温度过低而析出Na2CO3·10H2O晶体,令后续的加热脱水耗时长。
(3) 若在实验室进行“趁热过滤”,可采取的措施是用已预热的布氏漏斗趁热抽滤。
(4) 若“母液”循环使用,可能出现的问题及其原因是问题:溶解时有大量沉淀生成,使Na2CO3损耗且产物Na2CO3混有杂质;原因:“母液”中,含有的离子有Ca2+,Na+,Cl -,SO42-,OH -,CO32-,当多次循环后,使用离子浓度不断增大,溶解时会生成CaSO4,Ca(OH)2,CaCO3等沉淀。
(5) 写出Na2CO3·H2O脱水反应的热化学方程
Na2CO3·H2O(S)==== Na2CO3(s) + H2O(g) H= +58.73kJ/mol
[解析]
(1)因工业碳酸钠中含有Mg2+,Fe3+,Ca2+,所以“除杂”中加入过量的NaOH溶液,可生成Mg(OH)2、Fe(OH)3、Ca(OH)2沉淀。
(2)观察坐标图,温度减少至313K时发生突变,溶解度迅速减少,弱不趁热过滤将析出晶体。
(3)思路方向:1.减少过滤的时间 2.保持过滤时的温度。
(4)思路:分析“母液”中存在的离子,若参与循环,将使离子浓度增大,对工业生产中哪个环节有所影响。
(5)通过观察两个热化学方程式,可将两式相减,从而得到Na2CO3·H2O(S)==== Na2CO3(s)+ H2O(g)。

 2MgO;②3Mg+N2
2MgO;②3Mg+N2 