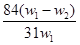摘要:14.为了检验某含有NaHCO3杂质的Na2CO3样品的纯度.现将w1 g样品加热.其质量变为w2 g.则该样品的纯度 A. B. C. D. 高考真题答案与解析 化 学 [考点14]钠及其化合物 20080822 1.答案:(1) 滤渣的主要成分为Mg(OH)2. Fe(OH)3.CaCO3. (2)“趁热过滤 的原因是使析出的晶体为Na2CO3·H2O.防止因温度过低而析出Na2CO3·10H2O晶体.令后续的加热脱水耗时长. (3) 若在实验室进行“趁热过滤 .可采取的措施是用已预热的布氏漏斗趁热抽滤. (4) 若“母液 循环使用.可能出现的问题及其原因是问题:溶解时有大量沉淀生成.使Na2CO3损耗且产物Na2CO3混有杂质,原因:“母液 中.含有的离子有Ca2+.Na+.Cl -.SO42-.OH -.CO32-.当多次循环后.使用离子浓度不断增大.溶解时会生成CaSO4.Ca(OH)2.CaCO3等沉淀. (5) 写出Na2CO3·H2O脱水反应的热化学方程 Na2CO3·H2O(S)==== Na2CO3(s) + H2O(g) H= +58.73kJ/mol [解析] (1)因工业碳酸钠中含有Mg2+.Fe3+.Ca2+.所以“除杂 中加入过量的NaOH溶液.可生成Mg(OH)2.Fe(OH)3.Ca(OH)2沉淀. (2)观察坐标图.温度减少至313K时发生突变.溶解度迅速减少.弱不趁热过滤将析出晶体. (3)思路方向:1.减少过滤的时间 2.保持过滤时的温度. (4)思路:分析“母液 中存在的离子.若参与循环.将使离子浓度增大.对工业生产中哪个环节有所影响. (5)通过观察两个热化学方程式.可将两式相减.从而得到Na2CO3·H2O(S)==== Na2CO3(s)+ H2O(g).
网址:http://m.1010jiajiao.com/timu3_id_59868[举报]
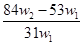 B.
B. C.
C. D.
D.