15.答案:(1)25% (2)增大 (3)6 (4)41%
[解析]本题主要考查了化学平衡移动、转化率、平衡常数等基本概念和基本计算,具有较强的综合性。在解题中注意平衡常数与转化率的巧妙应用,这也是本题的关键所在。
(1)N的转化率为

|
(2)因为反应△H>0,是吸热反应,所以升高温度,平衡向正反应方向移动,M的转化率增大。
(3)根据反应
 M(g) + N(g) P(g) +
Q(g)
M(g) + N(g) P(g) +
Q(g)
起始浓度:4mol·L-1 a mol·L-1 0 0
转化浓度:2mol·L-12mol·L-12mol·L-1 2mol·L-1
平衡浓度:2mol·L-1(a–2)mol·L-12mol·L-12mol·L-1
根据温度不变,平衡常数不变的特点
K=2mol·L-1×2mol·L-1/[2mol·L-1×(a –2) mol·L-1]=0.6mol·L-1×0.6mol·L-1/[0.4mol·L-1×1.8mol·L-1]得a =6mol·L-1
 (4)同理:M(g) +
N(g)
P(g) + Q(g)
(4)同理:M(g) +
N(g)
P(g) + Q(g)
起始浓度:bmol·L-1 b mol·L-1 0 0
转化浓度:xmol·L-1xmol·L-1xmol·L-1 xmol·L-1
平衡浓度:(b-x)mol·L-1(b–x)mol·L-1xmol·L-1xmol·L-1
根据温度不变,平衡常数不变的特点
K=x2/(b – x )2=0.6mol·L-1×0.6mol·L-1/[0.4mol·L-1×1.8mol·L-1]得x=0.41b mol·L-1
a(M)=(0.41b/b)×100%=41%
 2Z。
2Z。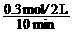 = 0.015 mol/(L·min)
= 0.015 mol/(L·min)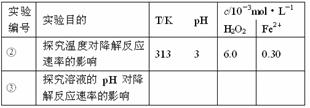
 ; 0.015 mol/(L·min)。
; 0.015 mol/(L·min)。