2.[江苏省启东中学2009届高三最后一考]A(12分)决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
|
电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
|
A |
578 |
1817 |
2745 |
11578 |
|
B |
738 |
1451 |
7733 |
10540 |
A通常显________价,A的电负性_____B的电负性(填“>”、“<”或“=”)。
(2)已知:波长为300nm的紫外光的光子所具有的能量约为399 kJ/mol。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:__________________________________________________________________________
|
共价键 |
C-C |
C-N |
C-S |
|
键能/ kJ·mol-1 |
347 |
305 |
259 |

(3)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似(如右图所示),其中3种离子晶体的晶格能数据如下表:
|
离子晶体 |
NaCl |
KCl |
CaO |
|
晶格能/kJ·mol-1 |
786 |
715 |
3401 |
离子键的强弱可以用离子晶体的晶格能来衡量。KCl、MgO、CaO、TiN 4种离子晶体熔点从高到低的顺序是_____________________________。MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有__________________个。
(4)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是__________________。
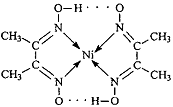
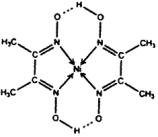 (5)某配合物的分子结构如下图所示,其分子内不含有_____________(填标号)。
(5)某配合物的分子结构如下图所示,其分子内不含有_____________(填标号)。
A. 离子键
B. 共价键
C. 金属键
D. 配位键
E.氢键
答案、(1)+3(1分);>(1分)
(2)紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子(2分)
(3)TiN>MgO>CaO>KCl(2分);12(2分) (4)CrO2(2分) (5)AC(2分)
3( 江苏省淮阴中学2009届高三化学仿真模拟试题 )四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。
|
元素 |
A |
B |
C |
D |
|
性质 结构 信息 |
原子核外有两个电子层,最外层有3个未成对的电子 |
原子的M层有1对成对的p电子 |
原子核外电子排布为[Ar]3d104sx, 有+1、+2两种常见化合价 |
有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
⑴写出B原子的电子排布式 。
⑵A元素的氢化物的沸点比同主族相邻元素氢化物沸点 (填“高”或“低”),其原因是___________________________________________________________________。
⑶D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点 (填“高”或“低”),其原因是_______________________________________________________。
⑷往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为________________,简要描述该配合物中化学键的成键情况__________________。
 ⑸下列分子结构图中的“
”表示上述相关元素的原子中除去最外层电子的剩余部分,
⑸下列分子结构图中的“
”表示上述相关元素的原子中除去最外层电子的剩余部分,
“ ”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。
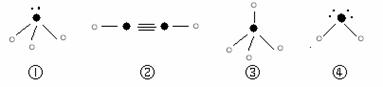
则在以上分子中,中心原子采用sp3杂化形成化学键的是 (填写序号);
在②的分子中有 个σ键和 个π键。
答案、⑴ 1s22s22p63s23p4 (1分)
⑵高,因为A的氢化物分子间存在氢键 (各1分)
⑶低,晶体类型不同 (各1分)
⑷[Cu(NH3)4]SO4(1分), 中心原子与配位体之间以配位键相结合,内界与外界之间以离子键相结合(1分)
⑸①③④(3分);3 (1分) 2(1分)
17.(8分)有关物质的熔、沸点数据如下表:
|
|
MgO |
Al2O3 |
MgCl2 |
AlCl3 |
|
熔点/℃ |
2852 |
2072 |
741 |
190(2.5×105Pa) |
|
沸点/℃ |
3600 |
2980 |
1412 |
182.7 |
请参考上述数据填空和回答问题。
(1)工业上常用电解熔融MgCl2的方法生产金属镁,不用电解熔融MgO的方法生产镁,原因是 能用电解熔融AlCl3的方法生产铝吗? (填能或不能),原因是:
(2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实验方法是:
。
 (5)治癌药物B的结构简式为
▲
。
(5)治癌药物B的结构简式为
▲
。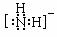
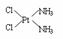
 分子内的作用力有
(填编号)。
分子内的作用力有
(填编号)。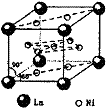 ⑶很多不饱和有机物在Ni催化下可以与H2发生加成反应。如①CH2=CH2、②CH≡CH、③
⑶很多不饱和有机物在Ni催化下可以与H2发生加成反应。如①CH2=CH2、②CH≡CH、③ 、④HCHO等,其中碳原子采取sp2杂化的分子有
、④HCHO等,其中碳原子采取sp2杂化的分子有
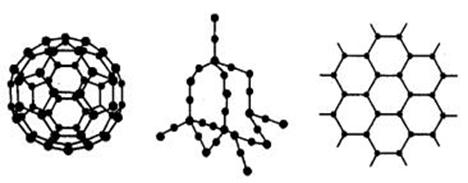 (1)C60、金刚石和石墨三者的关系互为________。
A、同分异构体 B、同素异形体
C、同系物 D、同位素
(2)固态时,C60属于________晶体(填“离子”“原子”或“分子”)
(1)C60、金刚石和石墨三者的关系互为________。
A、同分异构体 B、同素异形体
C、同系物 D、同位素
(2)固态时,C60属于________晶体(填“离子”“原子”或“分子”)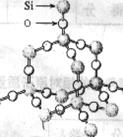 二氧化硅晶体是空间网状结构,如右图所示。关于二氧化硅晶体的下列说法中,不正确的是( )
二氧化硅晶体是空间网状结构,如右图所示。关于二氧化硅晶体的下列说法中,不正确的是( )