9、电解规律(用惰性电极电解)
|
电解类型 |
物质类型 |
电解反应 |
电解实质 |
电解质溶液中浓度变化 |
溶液pH变化 |
电解质溶液复原来 |
|
电解溶剂型 |
强碱(NaOH) |
|
|
|
|
|
|
含氧酸(H2SO4) |
|
|
|
|
|
|
|
活泼金属的含氧酸盐(Na2SO4) |
|
|
|
|
|
|
|
电解溶质型 |
无氧酸(HCl) |
|
|
|
|
|
|
不活泼金属的无氧酸盐(CuCl2) |
|
|
|
|
|
|
|
溶质溶剂同时被电解 |
活泼金属的无氧酸盐(NaCl) |
|
|
|
|
|
|
不活泼金属的含氧酸盐(CuSO4) |
|
|
|
|
|
|
|
不活泼金属的含氧酸盐(AgNO3) |
|
|
|
|
|
 例1:(2004,上海)右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )
例1:(2004,上海)右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )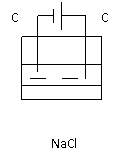 例2:写出右图的电极反应:阴极:
例2:写出右图的电极反应:阴极:
 C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+
C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+ 
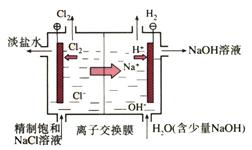 氯碱工业:
氯碱工业: