1.(2007海南·22)下列叙述正确的是 ( )
A.分子晶体中的每个分子内一定含有共价键
B.原子晶体中的相邻原子间只存在非极性共价键
C.离子晶体中可能含有共价键
D.金属晶体的熔点和沸点都很高
20.答案: (1)原子晶体。(2)NO2和N2O4。(3)As2S5。
(4)①NH3>AsH3>PH3。 NH3分子间存在氢键,所以沸点最高,相对分子质量AsH3>PH3,分子间作用力AsH3>PH3,故沸点AsH3>PH3。
②SiH4正四面体, PH3三角锥, H2S角形(或V形)。
(5)SiCl4+4NH3 Si(NH2)4+4HCl,3Si(NH2)4
Si(NH2)4+4HCl,3Si(NH2)4 8NH3+Si3N4
8NH3+Si3N4
[解析]判断出这五种元素是解题的关键。
思路:W的氯化物为正四体型,则W为C或Si。若W为C,则中心元素X为Si,右边的含氧酸H3PO4不是强酸,不符。所以W为Si、X为P、Y为S(H2SO4是强酸);再从“W与Q形成高温陶瓷”知Q为N(形成Si3N4)、R为As。如下表:
|
C |
N(Q) |
|
|
Si(W) |
P(X) |
S(Y) |
|
|
As(R) |
|
(4)②电子总数相同的氢化物应该是同周期的,所以是比较SiH4、PH3、H2S。
|

|
版权所有:()
版权所有:()
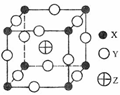 (2008年海南化学·24)已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的 ( )
(2008年海南化学·24)已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的 ( )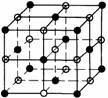 (2007海南·24)NaCl的晶胞 如右图,每个NaCl晶胞中含有的Na+离子和Cl
(2007海南·24)NaCl的晶胞 如右图,每个NaCl晶胞中含有的Na+离子和Cl 离子的数目分别是 ( )
离子的数目分别是 ( )