摘要:20.答案: NO2和N2O4.(3)As2S5. (4)①NH3>AsH3>PH3. NH3分子间存在氢键.所以沸点最高.相对分子质量AsH3>PH3.分子间作用力AsH3>PH3.故沸点AsH3>PH3. ②SiH4正四面体. PH3三角锥. H2S角形. (5)SiCl4+4NH3Si(NH2)4+4HCl.3Si(NH2)48NH3+Si3N4 [解析]判断出这五种元素是解题的关键. 思路:W的氯化物为正四体型.则W为C或Si.若W为C.则中心元素X为Si.右边的含氧酸H3PO4不是强酸.不符.所以W为Si.X为P.Y为S(H2SO4是强酸),再从“W与Q形成高温陶瓷 知Q为N(形成Si3N4).R为As.如下表: C N(Q) Si(W) P(X) S(Y) As(R) (4)②电子总数相同的氢化物应该是同周期的.所以是比较SiH4.PH3.H2S. () 来源: 版权所有:() 版权所有:() 版权所有:()
网址:http://m.1010jiajiao.com/timu3_id_59511[举报]
(2013?金华模拟)某物质M具有热导率高、高温下电绝缘性好、高温下材料强度大、无毒等优异性能.经检测,M中只含有两种短周期元素.现取82gM溶于适量的NaOH溶液中恰好反应,得到无色溶液A和44.8L气体B(气体体积为标准状况下),该气体能使红色石蕊试纸变蓝.往反应后的溶液中逐滴加入盐酸,可观察到溶液先变浑浊后变澄清.
物质B有如下转化关系:B
C
D
EE是一种强酸.将c和D的混合物溶解在接近零度的水中,即可得到一种弱酸F的水溶液.请回答下列问题:
(1)物质M的化学式为
(2)无色溶液A呈碱性,其原因是
(3)弱酸F是一种比醋酸酸性稍强的弱酸,很不稳定,通常在室温下易分解.要制得F溶液,可以往冷冻的其钠盐浓溶液中加入或通入某种物质,下列物质不适合使用的是
a.盐酸 b.二氧化碳 c.稀硫酸 d.二氧化硫
(4)工业碱性废水中若含有NO-2,可用铝粉除去.已知此反应体系中检测到B气体.写出上述反应的离子方程式
(5)现发现一种活性很强的化合物G,其组成为NH5,G遇水能产生两种气体,其中一种气体为B,则物质G的电子式为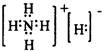
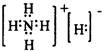 .
.
查看习题详情和答案>>
物质B有如下转化关系:B
| X |
| X |
| H2O |
(1)物质M的化学式为
AlN
AlN
,属于原子
原子
晶体(填“分子”、“离子”、“原子”等).(2)无色溶液A呈碱性,其原因是
AlO2-+2H2O=Al(OH)3+OH-
AlO2-+2H2O=Al(OH)3+OH-
(用离子方程式表示).(3)弱酸F是一种比醋酸酸性稍强的弱酸,很不稳定,通常在室温下易分解.要制得F溶液,可以往冷冻的其钠盐浓溶液中加入或通入某种物质,下列物质不适合使用的是
bd
bd
(填序号).a.盐酸 b.二氧化碳 c.稀硫酸 d.二氧化硫
(4)工业碱性废水中若含有NO-2,可用铝粉除去.已知此反应体系中检测到B气体.写出上述反应的离子方程式
2Al+NO2-+OH-+H2O=2AlO2-+NH3↑
2Al+NO2-+OH-+H2O=2AlO2-+NH3↑
.若改用电解法将废水中NO-2转换为N2除去,N2将在阴极
阴极
(填“阴极”或“阳极”)生成,电极反应为2NO2-+6e-+4H2O=N2+8OH-
2NO2-+6e-+4H2O=N2+8OH-
.(5)现发现一种活性很强的化合物G,其组成为NH5,G遇水能产生两种气体,其中一种气体为B,则物质G的电子式为
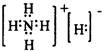
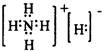
用序号填空:
(1)有下列八种物质:①MgCl2晶体②干冰③NaOH晶体④白磷(P4)晶体⑤金刚石⑥硼晶体.其中属于离子晶体的是
(2)有下列分子:①CO2②NO2③SO3④BF3⑤NH3,其中属于非极性分子的是
(3)在相同条件下,SO2在水中的溶解度和CO2在水中的溶解度相比,SO2的溶解度大,请从分子性质的角度阐述理由
(4)试比较同主族元素的氢化物H2O、H2S和H2Se的稳定性和沸点高低,并说明理由.
稳定性:
沸点:
查看习题详情和答案>>
(1)有下列八种物质:①MgCl2晶体②干冰③NaOH晶体④白磷(P4)晶体⑤金刚石⑥硼晶体.其中属于离子晶体的是
①③
①③
;属于分子晶体的是②④
②④
,属于原子晶体的是⑤⑥
⑤⑥
.(2)有下列分子:①CO2②NO2③SO3④BF3⑤NH3,其中属于非极性分子的是
①③④
①③④
,分子的VSEPR模型为平面三角形的是②③④
②③④
,属于分子的立体构型为三角锥形的是⑤
⑤
.(3)在相同条件下,SO2在水中的溶解度和CO2在水中的溶解度相比,SO2的溶解度大,请从分子性质的角度阐述理由
SO2是极性分子,CO2是非极性分子,水是极性分子,根据相似相溶原理,SO2在水中的溶解度比CO2的大
SO2是极性分子,CO2是非极性分子,水是极性分子,根据相似相溶原理,SO2在水中的溶解度比CO2的大
(4)试比较同主族元素的氢化物H2O、H2S和H2Se的稳定性和沸点高低,并说明理由.
稳定性:
H2O>H2S>H2Se
H2O>H2S>H2Se
理由:非金属性越强,气态化合物越稳定,非金属性O>S>Se
非金属性越强,气态化合物越稳定,非金属性O>S>Se
.沸点:
H2O>H2Se>H2S
H2O>H2Se>H2S
理由:H2O可形成分子间氢键,沸点最高,H2Se相对分子质量比H2S大,分子间作用力大,因而H2Se比H2S沸点高
H2O可形成分子间氢键,沸点最高,H2Se相对分子质量比H2S大,分子间作用力大,因而H2Se比H2S沸点高
.已知周期表中,元素Q、R、W、Y与元素X相邻.Y的最高化合价氧化物的水化物是强酸.回答下列问题:
(1)W与Q可以形成一种高温结构陶瓷材料.W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是
(2)Q的具有相同化合价且可以相互转变的氧化物是
(3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是
(4)这5个元素的氢化物分子中,立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式)
(5)电子总数相同的氢化物的化学式和立体结构分别是
查看习题详情和答案>>
(1)W与Q可以形成一种高温结构陶瓷材料.W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是
原子晶体
原子晶体
;(2)Q的具有相同化合价且可以相互转变的氧化物是
NO2和N2O4
NO2和N2O4
;(3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是
As2S5
As2S5
;(4)这5个元素的氢化物分子中,立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式)
NH3>AsH3>PH3
NH3>AsH3>PH3
,其原因是NH3分子间存在氢键,所以沸点最高.相对分子质量AsH3>PH3,则AsH3分子间的作用力大于PH3,故沸点AsH3>PH3
NH3分子间存在氢键,所以沸点最高.相对分子质量AsH3>PH3,则AsH3分子间的作用力大于PH3,故沸点AsH3>PH3
(5)电子总数相同的氢化物的化学式和立体结构分别是
SiH4正四面体、PH3三角锥型、H2SV型(角型)
SiH4正四面体、PH3三角锥型、H2SV型(角型)
.
用序号填空:
(1)有下列八种物质:①MgCl2晶体 ②干冰 ③NaOH晶体 ④白磷(P4)晶体⑤金刚石 ⑥硼晶体.其中属于离子晶体的是 ;属于分子晶体的是 ,属于原子晶体的是 .
(2)有下列分子:①CO2②NO2③SO3④BF3⑤NH3 其中属于非极性分子的是 ,分子的VSEPR模型为平面三角形的是 ,属于分子的立体构型为三角锥形的是 .
(3)在相同条件下,SO2在水中的溶解度和CO2在水中的溶解度相比,SO2的溶解度大,请从分子性质的角度阐述理由
(4)有下列四种无机含氧酸:①H3PO4 ②HClO ③H3BO3 ④HNO2根据无机含氧酸的酸性规律,将四种无机含氧酸按酸性相近两两组成一组,它们分别是 , .
查看习题详情和答案>>
(1)有下列八种物质:①MgCl2晶体 ②干冰 ③NaOH晶体 ④白磷(P4)晶体⑤金刚石 ⑥硼晶体.其中属于离子晶体的是
(2)有下列分子:①CO2②NO2③SO3④BF3⑤NH3 其中属于非极性分子的是
(3)在相同条件下,SO2在水中的溶解度和CO2在水中的溶解度相比,SO2的溶解度大,请从分子性质的角度阐述理由
(4)有下列四种无机含氧酸:①H3PO4 ②HClO ③H3BO3 ④HNO2根据无机含氧酸的酸性规律,将四种无机含氧酸按酸性相近两两组成一组,它们分别是
W、X、Y、Z均为短周期主族元素,W的最外层电子数与核外电子总数之比为3:8;X的核外电子总数与Y的最外层电子数相等,X的原子序数是Z的原子序数的一半;W、Y、Z位于同一周期.
(1)W的单质是一种

Z单质的晶体类型是
(2)W、Y、Z三种元素的气态氢化物稳定性由高到低的顺序是
(3)已知A、B、C、D四种物质存在的反应关系:A+B-→C+D
①若A是Y和Z常见价态的化合物,B是X的氢化物,D是Y的氢化物,反应过程中没有化合价变化,该反应的化学方程式是
②若A是Z的单质,B为红色固体,D为紫红色固体单质,高温下发生该反应,C的化学式是
查看习题详情和答案>>
(1)W的单质是一种
黄
黄
色晶体.写出X的氢化物的电子式

Z单质的晶体类型是
原子晶体
原子晶体
类型(2)W、Y、Z三种元素的气态氢化物稳定性由高到低的顺序是
HCl>H2S>SiH4
HCl>H2S>SiH4
.(用化学式表示,Z的气态氢化物与其同主族元素气态氢化物化学式写法相似).(3)已知A、B、C、D四种物质存在的反应关系:A+B-→C+D
①若A是Y和Z常见价态的化合物,B是X的氢化物,D是Y的氢化物,反应过程中没有化合价变化,该反应的化学方程式是
3SiCl4+4NH3═Si3N4+12HCl
3SiCl4+4NH3═Si3N4+12HCl
.②若A是Z的单质,B为红色固体,D为紫红色固体单质,高温下发生该反应,C的化学式是
SiO2
SiO2
.D与X元素最高价氧化物对应水化物的浓溶液反应,生成的气体会对大气造成污染.用烧碱溶液吸收该气体生成两种盐,其中一种盐可用作防腐剂,烧碱溶液吸收气体的离子方程式是2NO2+2OH-═NO2-+NO3-+H2O
2NO2+2OH-═NO2-+NO3-+H2O
.