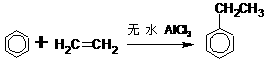
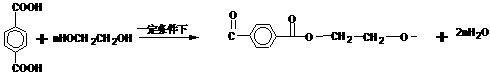
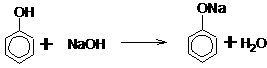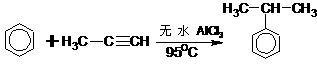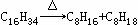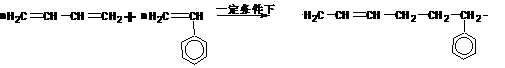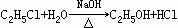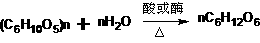(二)非选择题
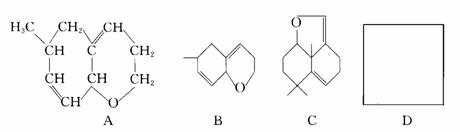
1.有机环状化合物的结构简式可进一步简化,例如A式可简写为B式。C式是1990年公开报道的第1000万种新化合物,该化合物C中的碳原子数是 ,分子式是 。若D是C的同分异构体,但D属酚类化合物,而且结构中没有-CH3基团。请写出D可能的结构简式(任意一种,填入D方框中)。
2.结构中没有环状的烷烃又名开链烷烃,其分子式通式是CnH2n+2(n是正整数)。 若它分子中每减少2个碳氢键,必然同时会增加1个碳碳键。该碳碳键可能是重键(双键或三键),也可能是连结成环状烃,都称为增加了1个不饱和度(用希腊字母Ω表示,又名“缺氢指数”)。例如若干烃类分子和烃基的不饱和度如下:
①CH3CH2CH3 Ω=0; ②(CH3)2CH- Ω=0;
③CH2 CHCH2 Ω=1;
CHCH2 Ω=1;
④ Ω=1; ⑤C8H15- Ω=1;
Ω=1; ⑤C8H15- Ω=1;
⑥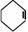 Ω=2; ⑦
Ω=2; ⑦  Ω=2;
Ω=2;
⑧CH3C≡CCH2C H=CH2 Ω=3;
⑨CH3(CH=CH)3CH3 Ω=3;
⑩? Ω=4;11? Ω=4;12C7H7-Ω=4。
(1)请写出下列各烃分子的Ω。
(A) Ω=
Ω=
(B) Ω=
Ω=
(C)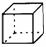 Ω=
Ω=
(2)请写出下列烃基的Ω。
(D)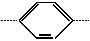 (两价基团)Ω=
(两价基团)Ω=
(E)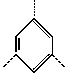 (三价基团)Ω=
(三价基团)Ω=
(F)?C≡C?(两价基团)Ω=
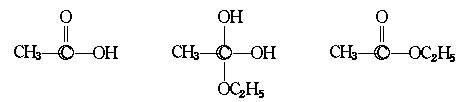
3.化学上拉席希法制备肼是将NaClO和NH3按物质的量1∶2混合,刚好反应生成NaCl、肼和水。肼是一种高能燃料。
(1)写出肼的化学式 ,推测其结构简式 。
(2)推测肼能否像氨一样和水形成水合物,如能形成水合物,写出反应的化学方程式。如不能形成水合物,说明理由: 。
4.4 mL O2和3 mL NxHy(已知x<y)混合气体在120℃、1.01×106Pa点燃完全反应后恢复到原温度和压强时,测得反应后N2、O2、H2O(g)混合气体密度减小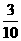 。试回答:
。试回答:
(1)写出反应的化学方程式: 。
(2)推算出NxHy的化学式 。
5.“汽车尾气污染”问题已备受世人的关注。汽车汽油(辛烷C8H18)引擎若采用电 火花去点燃汽缸中的燃料和空气混合物,汽缸内发生燃烧,燃烧是急速而猛烈的,温度很高。当活塞从汽缸里往外推出时,燃烧的气体跟着在不到百分之一秒的时间内受到膨胀和冷却,因此燃料必有一部分来不及燃烧或不完全氧化。
(1)根据你所学的知识写出汽缸内可能发生的反应的化学方程式。
(2)假设辛烷在汽缸内完全燃烧,则空气质量与辛烷质量之比x值是 。
(3)若空气质量与辛烷质量之比大于x值,则汽车尾气中有害气体含量较多的是 ;若空气质量与辛烷质量之比小于x值,则汽车尾气中有害气体含量较多的是 。
6.美国《科学美国人》杂志在1971年7月刊登的“地球的能量资源”一文中提供了如下数据 :
地球的能量资源数据
|
太阳辐射能的几条主要去路 |
功 率 |
|
直接反射 |
52000×109kJ/s |
|
以热能方式离开地球 |
81000×109kJ/s |
|
水循环 |
40000×109kJ/s |
|
大气流动 |
370×109kJ/s |
|
光合作用 |
40×109kJ/s |
请选用以上数据计算:
(1)地球对太阳能的利用率约为 。
(2)通过光合作用,每年有 kJ的太阳能转化为化学能(每年按365天计)。
(3)每年由绿色植物通过光合作用(6CO2+6H2O C6H12O6+6O2
)为我们生存的环境除去二氧化碳的质量设为A。试根据能量关系列出A的计算式。
C6H12O6+6O2
)为我们生存的环境除去二氧化碳的质量设为A。试根据能量关系列出A的计算式。
列式中缺少的数据用符号表示。
A= (kg)。
所缺数据的化学含义为 。
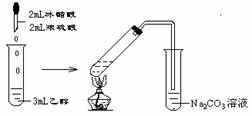
7.已知卤代烃和氢氧化钠的醇溶液共热可以得到烯烃。如CH3CH3Cl+NaOH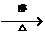 CH2=CH2+NaCl+H2O.现通过以下步骤由
CH2=CH2+NaCl+H2O.现通过以下步骤由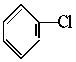 制取
制取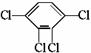 ,其合成流程如下:
,其合成流程如下:
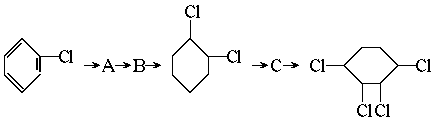 (卤代烃制取烯烃的反应属于消去反应)
(卤代烃制取烯烃的反应属于消去反应)
(1)从左到右依次填写每步所属 的反应类型是(a.取代 b.加成 c.消去反应,只填字母) 。
(2)写出A→B反应所需的试剂和条件 。
(3)写出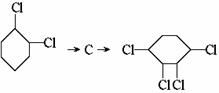 这两步反应的化学方程式
。
这两步反应的化学方程式
。
8.有机物A、B、C、中碳、氢、氧元素物质的量之比为1∶2∶1,它们都能发生银镜反应, 但都不能发生水解反应。B1、B2是B的同分异构体。又知:
A在常温下为气体,A+C6H5OH Z(高分子化合物)
Z(高分子化合物)
B1在16.6℃以下凝为冰状晶体:B1+Na2CO3 X+CO2;X+NaOH
X+CO2;X+NaOH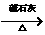 Y(最简单的烃)
Y(最简单的烃)
B2为无色液体,也能发生银镜反应。1 mol C完全燃烧需要3 mol氧气。试回答:
(1)B2的名称 ,A、B的结构简式:A 、B ;
(2)写出X→Y的化学方程式: ;
(3)C的结构简式 ,与C互为同分异构体,且属于乙酸酯类化合物的结构简式 , 。
9.某有机物A的结构简式为:
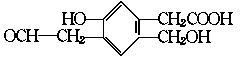
(1)等量的该有机物分别与足量的Na、NaOH、新制Cu(OH)2充分反应时,理论上消耗三种物 质的物质的量之比为 。
(2)A在浓H2SO4作用下,若发生分子内脱水,所生成产物的结构简式为: 。
10.只含有C、H、O的有机物A和B,它们的最简式相同,但A的相对分子质量大于B,将1.50 g A或B完全燃烧后的气体依次通过无水氯化钙和碱石灰,测得分别增重0.90 g、2.20 g;若 A、B以等物质的量混合,取其2.25 g在127℃和1.01×105Pa时气化后体积为1.64L。求:( 1)A、B的最简式。(2)A、B的相对分子质量和分子式。
11.已知有机物A的结构式为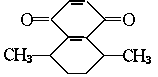 ,其化学式为
。
,其化学式为
。
有机物B是萘的衍生物,且不含-CH3,B与A互为同分异构体,根据要求写出B可能的结构简式并完成下列两问:
(1)与醇能发生酯化反应的是 。
(2)与新制备氢氧化铜在一定条件下作用,产生红色沉淀的是 和 。
12.液晶是一类新型材料,MBBA是一种研究得较多的液晶化合物,它可以看作是由醛A和胺B 去水缩合的产物。
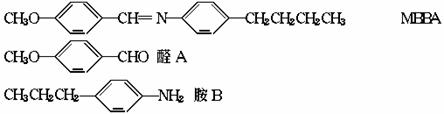
(1)对位上有-C4H9的苯胺可能有四个异构体,它们是:
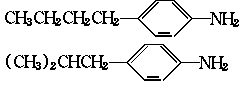
、 。
(2)醛A的异构体甚多,其中属于酯类化合物,而且结构式中的苯环结构的异构体就有六个, 它们是:
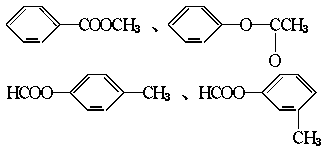
、 。
13.已知
 HOOC(CH2)4COOH,CH3CH=CH2
HOOC(CH2)4COOH,CH3CH=CH2 CH3COOH+CO2,
CH3COOH+CO2,
CH2=CH-CH=CH2+CH2=CH2
(1)分子式为C17H12的某烃氧化得
HOOC?CH?CH?CH2?COOH
│ │
CH CH
该烃的结构简式 。根据以上事实,可推测该二聚体的结构简式为: 。
(2)已知1,3-丁二烯聚合时,除生成高分子聚合物外,还有一种二聚体生成,且该二聚体发
生下列反应:a.加氢还原,生成乙基环己烷,b.加溴时可引入4个溴原子,c.氧化时可生成 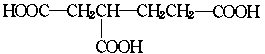 ,同时,还应有一种气体生成,该气体是:
。根据以上事实,可推测该二聚体的结构简式为:
。
,同时,还应有一种气体生成,该气体是:
。根据以上事实,可推测该二聚体的结构简式为:
。
14.已知卤代烃R-X在NaOH水溶液中能发生如下反应:
R-X+NaH R-OH+NaX
R-OH+NaX
现通过如下方法可合成分子量相等的两种有机物F和G。
请回答下列问题:
(1)有机物名称:C 、E 。
(2)上述反应①-⑥ ,属于加成反应的有 。
(3)F和G的相互关系属于 (填序号)
①同系物 ②同分异构体 ③同一物质 ④同一类物质
(4)A+E G的化学方程式为:
。
G的化学方程式为:
。
15.化合物A(C8H8O3)为无色液体难溶于水,有特殊香味,从A出发,可发生图示的一系列反应,图中的化合物A硝化时可生成四种一硝基取代物,化合物H的分子式为C6H6O,G能进行银镜反应。
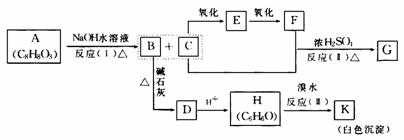
回答下列问题:
A、E、K可能的结构简式
A ,E ,K 。
16.维纶的成分是聚乙烯醇缩甲醛。它可以由乙烯为原料进行合成,其主要步骤是由乙烯氧化和醋酸合成醋酸乙烯酯。化学方程式如下:
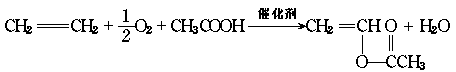
然后经加聚、水解、缩聚制得。请把下列各步变化中指定的有机产物的结构 简式填入空格内:

C4H6O2 (C4H6O2)n (C2H4O)n 维纶(C5H8O2)n
17.不饱和烃可发生催化氧化:
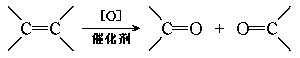
在上述条件下把n mol分子组成都为C5H10的不饱和烃氧化,可得0.4n mol酮和n mo l甲醛以及其他有机产物请填空:
(1)不饱和烃的混合物中,肯定存在的一种烃的结构简式是 ,该烃的物质的量分数 为 。
(2)氧化产物中,除甲醛外,还可能存在的其他有机产物的结构简式 。
(3)在生成高分子化合物
?CH2CH2CH2?CH?CH2?CH2CH=CHCH2?n的三种单体中 ,可能属于上述不饱和烃混合物的
|
CH3CHCH3
一种组分的结构简式为 。
18.将羧酸的碱金属盐溶液电解可得到烃类化合物。例如
2CH3COOK+2H2O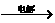
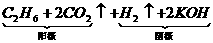
卤代轻具有下列性质:
R-Br+H2O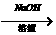 R-OH+HBr
R-OH+HBr
根据下列衍变关系回答有关问题:
ClCH2COOK(溶液)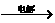 A混合物
A混合物 B
B C
C D
D E
E
(1)写出电极反应式:
阳极:
阴极:
(2)写出A→B的化学方程式:
(3)D和B在不同条件下反应,会生成三种不同的E,试写出它们的结构简式:
键状E:
环状E:
高分子E:
19.傅瑞德尔一克拉福茨反应是在苯环上引入烷基的反应: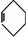 +CH3CH2Cl
+CH3CH2Cl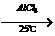
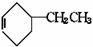 +HCl;乙苯还可发生下列反应:
+HCl;乙苯还可发生下列反应: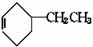
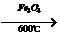
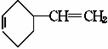 +H2;又已知烯烃与HA加成时,氢原子总是加在含氢较多的不饱和碳上,即:R-CH=CH2 +HA
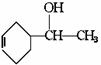
+H2;又已知烯烃与HA加成时,氢原子总是加在含氢较多的不饱和碳上,即:R-CH=CH2 +HA R-CH-CH3试以电石、 苯等为原料制备苯乙醇
R-CH-CH3试以电石、 苯等为原料制备苯乙醇
|
A
( ),写出各步反应的化学方程式:
),写出各步反应的化学方程式:
(1) ; (2) ;
(3) ; (4) ;
(5) ; (6) ;
(7) 。
20.取3.320 g只含羧基,不含其他官能团的固态芳香族羧酸置于4L氧气中,经点燃,羧酸 完全燃烧。反应后气体体积增加0.224 L。将气体通过足量的固体Na2O2后,体积减小1. 792 L(所有体积均为标准状况下测定)。请回答:
(1)3.320 g该羧酸中C、H、O三元素的物质的量;
(2)写出该羧酸的最简式;
(3)写出符合以上条件的相对分子质量最小的芳香族羧酸的结构简式。
21.1 mol某饱和烃的含氧衍生物A与2 mol NaOH在一定条件下恰好完全反应,生成1 mol 钠 盐。A的相对分子质量不超过120,氧的质量分数不超过0.543。试回答以下问题:
(1)A的一个分子中至少有 个氧原子。
(2)A的分子式是 。
(3)A有 种可能的不同结构。其中能通过简单试管实验鉴别出来的是 。
(4)1 mol A与2 mol NaOH反应,生成1 mol钠盐外还可能生成 。(可填满也可不填满)。
22.由三种化合物组混合物X,组成它的三种化合物A、B、C互为同分异构体,经实验测得下 列结果:
(1)X在标准状况下的密度为2.679 g/L;
(2)把1.8g X完全燃烧得3.96g CO2和2.16g H2O,无其他燃烧产物;
(3)2.0g X与Na反应生成标准状况下的H2 149mL,此时C不反应而残留;
(4)取2.0g X用酸性KMnO4溶液氧化,其中A氧化的最终产物不与Na2CO3反应;B氧化的最终产物0.74 g,可与Na2CO3反应放出气体。
试确定A、B、C的结构简式及物质的量之比。
23.已知
有机玻璃可按下列路线合成:

F亦可由水煤气在高温、高压、催华剂存在下合成。试写出:
(1)天然气的主要成分和C的结构简式分别为 、 。
(2)E+F G的反应方程式为
。
G的反应方程式为
。
(3)丙烯 A和A
A和A B的反应类型分别属于
、
。
B的反应类型分别属于
、
。
(4)G 有机玻璃的反应方程式为:
。
有机玻璃的反应方程式为:
。
24.石油及其分馏产物在供氧不足时燃烧,常常产生CO,这也是常见的大气污染物之一。将某气态烃在5倍体积的纯氧中燃烧,产物通过足量Na2O2,并在电火花连续作用下充分反应,生成的气体体积缩小到燃烧产物体积的3/8(气体体积都在100℃以上,1.01×105Pa时测定)。
(1)试写出通式为CxHy的某烃在供氧不足时燃烧的化学方程式。
(2)若(1)反应中,生成m mol CO2,则当m=2时该烃的分子式。
(3)若1 mol某气态烃在供氧不足时燃烧,产物在足量Na2O2和电火花连续作用下产生3 m olO2,且固体Na2O2增重范围为90 g≤ΔW≤118 g,求烃可能的分子式和燃烧产物CO 与CO2的物质的量之比,将结果填入下表。
|
烃的分子式 |
n(CO)∶n(CO2) |
|
|
|
25.在国际环境问题中,一次性使用的聚苯乙烯材料所带来的“白色污染”问题甚为突出。 德国Danone公司开发出具有60天自行降解功能的绿色食品杯--聚乳酸(分子组成可表示为C 3nH4n+2O2n+1)包装材料。
(1)聚苯乙烯为什么会造成“白色污染?” 。
(2)乳酸可以从甜菜发酵的糖液中提取,然后通过 反应生成聚乳酸。合成聚乳酸的 化学方程式为 。
(3)聚乳酸的降解可分为两个阶段,首先是化学水解成乳酸单体,然后乳酸单体在微生物的 作用下分解,生成二氧化碳和水。聚乳酸自行降解的两步反应的方程式为 。(经测定,聚乳酸材料分子结构中含支链)
26.(1)人类所使用的能量绝大部分来源于太阳能。捕获太阳能的生物主要为绿色植物。绿 色植物能够通过光合作用把太阳能转变为化学能。写出光合反应的化学方程式: 。
(2)煤、石油、天然气等能源以热的形式供给人们需要的能量,试以它们各自的主要成分C、 CnH2n+2和CH4为代表,写出它们燃烧过程的化学方程式:
(3)大气中二氧化碳的增多会造成温室效应。指出煤、石油、天然气这三种物质在质量相同时,哪一种燃料对环境造成负面影响最小?
27.1976年P.Inoue报道用Pd-磷化物催化二氧化碳和丁二烯的反应,可得的产物之一是:
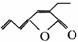
若有机物乙与甲互为同分异构体,乙能与FeCl3溶液作用显紫色,且分子结构中不存在甲 基,乙与适量新Cu(OH)2的悬浊液在加热的条件下,反应可产生砖红色的沉淀,则:
(1)有机物甲的分子式为 .
(2)在一定条件下,能跟1 mol乙起加成反应的H2的最大用量为 mol.
(30若常温下与1 mol乙起取代反应需消耗Br2的最大用量为2mol,写出有机物乙可能的结构 简式 .
28.已知丙二酸(HOOC-CH2-COOH)用P2O5脱水得到的主要产物的分子式是C3O2,它跟水加成仍得丙二酸.C3O2是一种非常“活泼”的化合物,除能跟水加成生成丙二酸外,还能跟NH3、HCl、ROH(R为链烃基)等发生加成反应.例如C3O2跟NH3加成:C3O2+2NH3 CONH2
CONH2
|
CH2
|
CONH2
试写出:
(1)C3O2的结构简式:
(2)C3O2分别跟HCl、CH3CH2OH发生加成反应的化学方程式: ,
.
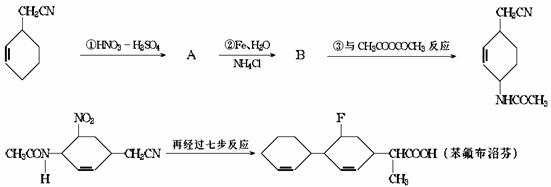
29.下面是某研制人员为合成药物苯氟布洛芬所设计的线路.
 回答下列问题:
回答下列问题:
(1)苯氟布洛芬的分子式为 .
(2)物质A、B的结构简式分别为 , .
(3)反应①-④中属于取代反应的是 (填反应代号).
(4)写出反应③的化学方程式(有机物写结构简式): .
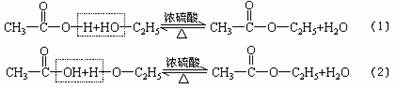
30.乙酸跟乙醇在浓硫酸存在并加热的条件下发生的酯化反应(反应A),其逆反应是水解反 应(反应B)。反应可能经历了中间体(I)这一步。
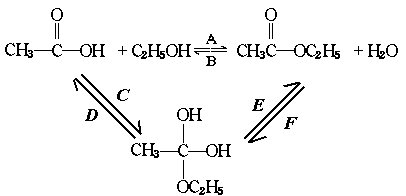
(Ⅰ)
(1)如果将反应按加成、消去、取代反应分类,则A-F6个反应中(将字母代号填入下列空格 中),属于取代反应的是 ;属于加成反应的是 ;属于消去应的是 。
(2)如果使原料C2H5OH,用18O标记,则生成物乙酸乙酯中是否有18O?如果使原料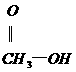 中羰基(
中羰基(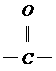 )
)
或羟基中的氧原子用18O标记,则生成物H2O中氧原子是否有18O?试简述你作此判断的理由。
(3)在画有圈号的3个碳原子中,哪一个(或哪些)碳原子的立体形象更接近甲烷分子中的碳原 子?试述其理由。
31.紫杉醇是一种新型搞癌药,其分子式为C47H51NO14,它是由如下的A酸和B醇生成的一种酯。
A.
(1)A可以在无机酸催化下水解,其反应方程式是
(2)A水解所得的氨基酸不是天然蛋白质水解产物,因为氨基不在(填希腊字母) 。
(3)写出ROH的分子式 位。
32.维生素C是一种水溶性维生互(呈酸性),分子式为C6H8O6,人体缺乏这种维生素能 患坏血症,所以维生素C人称抗坏血酸。维生素C易被空气中的氧气氧化,加热易变质。在新 鲜的水果、蔬菜中都富含维生素C,新鲜橙汁中维生素C的含量在500mg·L-1左右。
校外活动小组测定某品牌的软包装橙汁中维生素C的含量,下面是测定实验分析报告。请填 写有关空白:
(1)测定目的:测定某品牌软包装橙汁中维生素C的含量
(2)测定原理:C6H8O6+I2 C6H6O6+2H+2I-
C6H6O6+2H+2I-
(3)实验用品及试剂:①仪器和用品(略)
②试剂:7.5×10-3mol·L-1标准碘溶液,指示剂 (填名称),蒸馏水等。
(4)实验过程:
①洗涤检查滴定管是否漏液,润洗后装好标准碘溶液待用。
②打开橙汁包装,用 (填仪器名称)向锥形瓶移入20.00mL待测 橙汁,滴入2滴指示剂。
③左手控制滴定管的 (填部位),右手摇动锥形瓶,眼睛注视 直到滴定终点,滴定点的现象是 。
33.下面是一个四肽,它可以看做是4个氨基酸缩合掉3水分子而得。
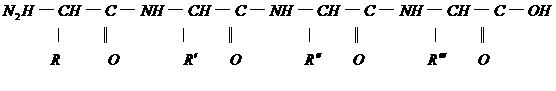 式中,R、R′、R″、
式中,R、R′、R″、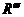 可能是相同的或不同的烃基,或有取代基的烃基。
可能是相同的或不同的烃基,或有取代基的烃基。
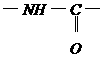 称为肽键。今有一个“多肽”,其分子式是C55H70O19N10,已知将它彻底水解后得到下列四种氨基酸:
称为肽键。今有一个“多肽”,其分子式是C55H70O19N10,已知将它彻底水解后得到下列四种氨基酸:
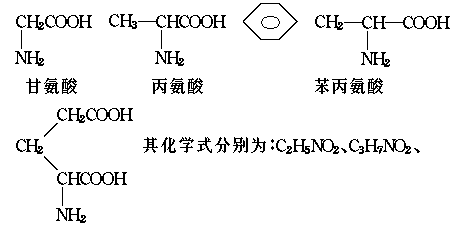
谷氨酸
C9H11NO2、C5H9NO4
问:(1)这个“多肽”是几肽?
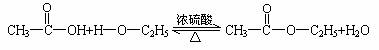

 CH-C≡CH,继续和氯化氢加成得到CH2=CH-CCl=CH2,所得产物加成聚合后得到354g?CH2CH=CClCH2?n,则所需乙炔的质量为( )
CH-C≡CH,继续和氯化氢加成得到CH2=CH-CCl=CH2,所得产物加成聚合后得到354g?CH2CH=CClCH2?n,则所需乙炔的质量为( )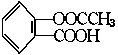 在适宜的条件下,阿斯匹林可能发生的反应有( )
在适宜的条件下,阿斯匹林可能发生的反应有( ) ,根据已有知识判定下列说法不正确的是( )
,根据已有知识判定下列说法不正确的是( )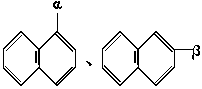 。下列化合物中α位有取代基的是( )
。下列化合物中α位有取代基的是( )
 两结构式( a、b分别代表不同的原子或原 子团)互为同分异构体,推断一氯丙烯的同分异构体(不含环状结构)共有( )
两结构式( a、b分别代表不同的原子或原 子团)互为同分异构体,推断一氯丙烯的同分异构体(不含环状结构)共有( )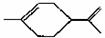 ),下列有关它的推测 正确的是( )
),下列有关它的推测 正确的是( )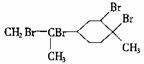
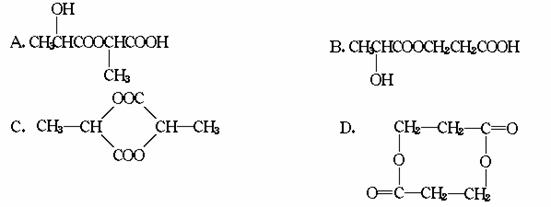

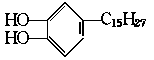 是我国特产生漆的主要成分,通常情况下为黄色液体,能溶于有机溶剂,生漆涂
在物体的表面,在空气中干燥后变成黑色的漆膜。将漆酚放入下列物质中:①空气,②溴水 ,③小苏打溶液,④氯化铁溶液,⑤通入过量的二氧化碳,不能发生化学反应的是( )
是我国特产生漆的主要成分,通常情况下为黄色液体,能溶于有机溶剂,生漆涂
在物体的表面,在空气中干燥后变成黑色的漆膜。将漆酚放入下列物质中:①空气,②溴水 ,③小苏打溶液,④氯化铁溶液,⑤通入过量的二氧化碳,不能发生化学反应的是( ) 。已知
。已知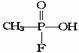 的名称为甲氟磷酸,则“沙林”的化学名称为( )
的名称为甲氟磷酸,则“沙林”的化学名称为( )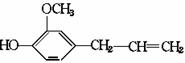 其可能具有的性质是:
其可能具有的性质是: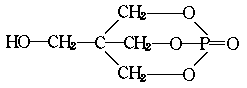
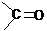 。例如:
。例如: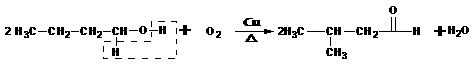
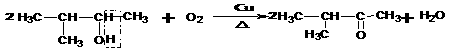
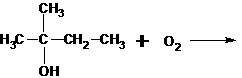 羟基所连碳原子上没有氢,不能形成
羟基所连碳原子上没有氢,不能形成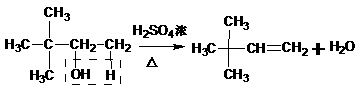
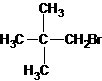 与Br原子相邻碳原子上没有氢,所以不能发生消去反应。
与Br原子相邻碳原子上没有氢,所以不能发生消去反应。
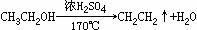 (分子内脱水)
(分子内脱水)
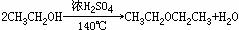 (分子间脱水)
(分子间脱水)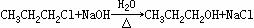 (取代)
(取代)
 (消去)
(消去)

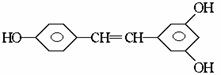 ,广泛存在于食物(例如桑椹、花生,尤其是葡萄)中。它可能具有抗癌性。该物质和溴水或 氢气反应时,能够跟1 mol 该化合物起反应的Br2或H2的最大用量分别是
mol。
,广泛存在于食物(例如桑椹、花生,尤其是葡萄)中。它可能具有抗癌性。该物质和溴水或 氢气反应时,能够跟1 mol 该化合物起反应的Br2或H2的最大用量分别是
mol。 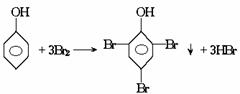
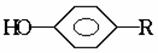 的酚和溴水发生取代反应时生成物应为
的酚和溴水发生取代反应时生成物应为 ;结构为
;结构为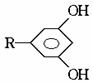 的酚和溴水发生取代反应时生成物应为
的酚和溴水发生取代反应时生成物应为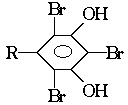 ,白藜芦醇分子
中还含有C=C不饱和键还能和溴水中的溴水发生加成反应,而白藜芦醇和氢气发生的是加成反应,其加成部位是二个苯环和一个C
,白藜芦醇分子
中还含有C=C不饱和键还能和溴水中的溴水发生加成反应,而白藜芦醇和氢气发生的是加成反应,其加成部位是二个苯环和一个C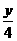 )O2
)O2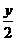 H2O,在相同条件下,
反应前后压强之比等于反应前后物质的量比。
H2O,在相同条件下,
反应前后压强之比等于反应前后物质的量比。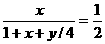 化简:y=4(x-1) 讨论:①当x=1 时,y=0舍去;②当x=2时,y=4;③当x=3时,y=8.答案:C、D.
化简:y=4(x-1) 讨论:①当x=1 时,y=0舍去;②当x=2时,y=4;③当x=3时,y=8.答案:C、D.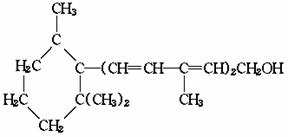
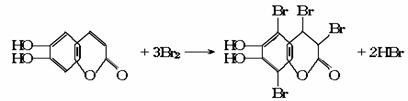
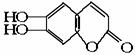 (碳氢原子未画出,每个折点表示一个碳原子),具有抗菌作用。若1mol 七叶树内酯,分别与 浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )
(碳氢原子未画出,每个折点表示一个碳原子),具有抗菌作用。若1mol 七叶树内酯,分别与 浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )