网址:http://m.1010jiajiao.com/timu3_id_51549[举报]
氮是地球上极为丰富的元素.填写下列空白.
(1)NH![]() 中N原子的杂化轨道类型为________,
中N原子的杂化轨道类型为________,
NH![]() 的空间构型为________.
的空间构型为________.
(2)常温下,锂可与氮气直接反应生成Li3N,Li3N晶体中氮以N3-存在,基态N3-的电子排布式为:________,Li3N晶体属于________晶体(填晶体类型).
(3)NH3的沸点为234K,NF3的沸点为154K,两者结构相似,NH3的沸点高于NF3的原因是:________.
(4)CO与N2相似,分子中都存在一个共价叁键,CO含________个π键.下表为CO与N2的相关信息.根据表中数据,说明CO比N2活泼的原因:________.

(5)根据下表数据,写出氮气与氢气反应生成氨气的热化学方程式________.
![]()
(6)CO与N2互为等电子体,其碳原子上有一对孤对电子,因此可作配体,如:Fe(CO)5、Ni(CO)4、Cr(CO)6等,在合成氨工业上中用铜洗液吸收CO,反应如下:

①基态Fe原子的未成对电子数有________个,
写出Cr、Cu+的价层电子排布式.________、________.
②醋酸二氨合铜(I)和醋酸羰基三氨合铜(I)都是配合物,[Cu(NH3)3CO]+中提供孤对电子的分子是:________,接受孤对电子的离子是:________,用箭号标出[Cu(NH3)2]+形成的配位键:________,[Cu(NH3)2]+中两个配位键的键角为180°,则Cu+采取________杂化与NH3形成配位键(填杂化类型).
③Ni(CO)4是无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂.推测Ni(CO)4是________分子(填“极性”或“非极性”).
(7)氮化硅是一种高温陶瓷材料,它硬度大、熔点高、化学性质稳定.
①氮化硅晶体属于________晶体(填晶体类型);
②已知氮化硅晶体结构中,原子间都以共价键相连,且N原子与N原子,Si原子与Si原子不直接相连,同时每个原子都满足8电子结构,请写出氮化硅的化学式:________.
(8)极纯的氮气可由叠氮化钠(NaN3)加热分解而得到.2NaN3(s)=2Na(l)+3N2(g),反应过程中,断裂的化学键是离子键和共价键,形成的化学键有________.
| 物质 | 氢气 | 一氧化碳 | 乙烷 | 乙烯 | 乙醇 |
| 化学式 | H2(g) | CO(g) | C2H6(g) | C2H4(g) | C2H5OH(l) |
| △H(kJ?mol-1) | -285.8 | -283.0 | -1559.8 | -1411.0 | -1366.8 |
(2)瑞尼镍是乙烯氢化反应的重要催化剂之一,它是用NaOH溶液处理铝镍合金,溶去铝后得到灰黑色的小颗粒多孔性的镍粉,写出该过程的化学方程式
(3)乙醇和CO2生成H2和CO混合气体,当其中氢气体积为1m3(标准状况)时,所需的能量为
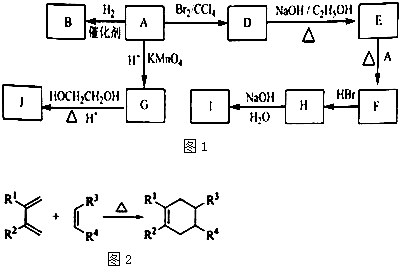
(1)环状化合物A的相对分子质量为82,其中含碳87.80%,含氢12.20%.B的一氯代物仅有一种,B的结构简式为
(2)M是B的一种同分异构体,M能使溴的四氯化碳溶液褪色,分子中所有的碳原子共平面,则M的结构简式为
(3)由A生成D的反应类型是
(4)G的分子式为C6H10O4,0.146gG需用20mL0.100mol/L NaOH溶液完全中和,J是一种高分子化合物.则由G转化为J的化学方程式为
(5)分子中含有两个碳碳双键,且两个双键之间有一个碳碳单键的烯烃与单烯烃可发生如图2反应则由E和A反应生成F的化学方程式为
(6)H中含有的官能团是
①6 M(甲)=3 M(乙)=3 M(丙)=3M(丁)=2M(戊)=M(己)=180;
②乙、戊的水溶液可使甲基橙试液变红,相互之间在一定条件下能发生酯化反应;
③戊的核磁共振氢谱显示有4种不同特征的氢原子,数量之比为3:1:1:1;
④甲、丙、丁、己均能发生银镜反应.丙不易溶于水但丁易溶于水.
请回答下列问题:
(1)甲的结构简式为
(2)乙、丙、丁三者之间的关系是
(3)写出2分子戊生成1分子环状酯的化学方程式


| 高温 |
完成下列填空:
(1)氮化硅可用于制造发动机的耐热部件,因为它属于


(2)比较Si和Cl两种元素非金属性强弱的方法是
a.比较两种元素的气态氢化物的沸点
b.比较两种元素的原子获得一个电子时释放能量的大小
c.比较两种元素的原子达到稳定结构获得电子的多少
d.比较相同条件下两种元素氢化物水溶液的酸性强弱
(3)Si与Al、Be具有相似的化学性质,因为