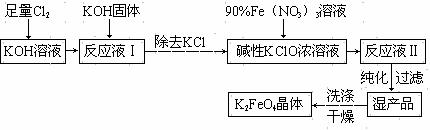
32.(16分)氯碱厂电解饱和食盐水制取NaOH的工艺流程如下:
(1)精制过程中反应的离子方程式为______________________________________________________ (任写2个)。
(2)电解过程的总反应方程式为_________________________________________。
(3)电解槽阳极产物可用于________________________________(至少写出两种用途)。
(4)已知NaOH、NaCl在水中的溶解度数据如下表:
|
温度/℃ |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
|
NaOH /g |
109 |
118 |
129 |
146 |
177 |
300 |
313 |
318 |
337 |
|
NaCl/ g |
36 |
36.3 |
36.6 |
37 |
37.3 |
37.8 |
38.4 |
39 |
39.8 |
根据上述数据,脱盐的主要工序应为_______________、_______________。脱盐后的碱液含NaOH约50%,含NaCl仅约2%左右,NaCl能够从溶液中大量析出的原因是________
______________________________________________________________________。
31.(16分)钛被称为继铁、铝之后的第三金属。如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染。
请填写下列空白:
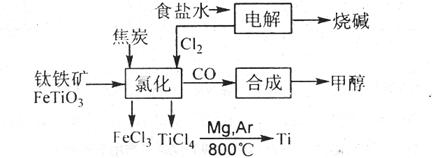
(1)电解食盐水时,总反应的离子方程式是 。
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式:
。
(3)已知:①.Mg(s)+Cl2(g)=MgC12(s) △H=-641kJ·mol-1
②Ti(s)+2C12(g)=TiCl4(s) △H=-770kJ·mol-1
则2Mg(s)+TiCl4(s)=2MgCl2(s)十Ti(s) △H= 。
|
反应2Mg(s)+TiCl4(s) 2MgCl2(s)+Ti(s)在Ar气氛中进行的理由是
。
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是 。

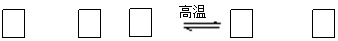
 (16分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
(16分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下: