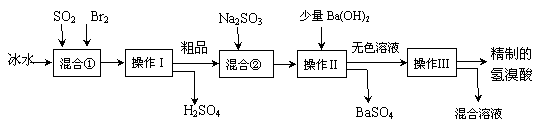
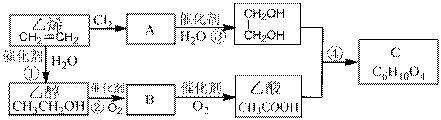
33.(16分)一包白色粉末中一定含有碳酸钠,可能还含有硫酸钠、氯化钠中的一种或两种,为进一步确认白色粉末的成份,某兴趣小组对白色粉末样品进行了探究。
可选用的仪器:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹
可选用的药品:1.0 mol·L-1H2SO4、1.0 mol·L-1HNO3、1.0mol·L-1HCl、NaOH稀溶液、0.1 mol·L-1AgNO3、0.1 mol·L-1BaCl2 、0.1 mol·L-1Ba(NO3)2、蒸馏水。
以下是实验探究过程:
1)提出假设:
假设1 白色粉末为 的混合物;
假设2 白色粉末为 的混合物;
假设3 白色粉末为碳酸钠、硫酸钠、氯化钠的混合物;
2)基于假设设计实验方案
3)根据实验方案进行实验
请回答:
(1)某同学取少许样品于试管中,加适量蒸馏水溶解,向试管中滴入0.1 mol·L-1的BaCl2溶液,有白色沉淀产生,他认为样品中含有Na2SO4。你认为他的结论是 (填“对的”或“错的”),原因是:
。
(2)基于假设3,请根据实验方案,将实验操作和预期的现象及结论填入下表中:
|
编号 |
实验操作 |
预期现象和结论 |
|
① |
|
有气体产生,说明样品中含有Na2CO3。 |
|
② |
向试管中加入0.1 mol·L-1的Ba(NO3)2 溶液。若有沉淀产生,则继续加入0.1
mol·L-1Ba(NO3)2至过量。 |
|
|
③ |
若②操作无沉淀,则向试管中加入0.1 mol·L-1AgNO3 溶液。若②操作中有沉淀,则将试管静置片刻后,取上层清液于另一去试管中,加入0.1 mol·L-1AgNO3溶液。 |
|
31.(16分)工业上可利用煤的气化产物(水煤气)合成二甲醚。
⑴ 煤的气化的主要化学反应方程式为:_____________________________________。
⑵ 煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:_________________________________________________________。
⑶ 利用水煤气合成二甲醚的三步反应如下:
① 2H2(g)+
CO(g) CH3OH(g) ΔH = -90.8
kJ·mol-1
CH3OH(g) ΔH = -90.8
kJ·mol-1
② 2CH3OH(g) CH3OCH3(g)+ H2O(g) ΔH= -23.5 kJ·mol-1
CH3OCH3(g)+ H2O(g) ΔH= -23.5 kJ·mol-1
③ CO(g)+ H2O(g) CO2(g)+ H2(g) ΔH= -41.3
kJ·mol-1
CO2(g)+ H2(g) ΔH= -41.3
kJ·mol-1
总反应:3H2(g)+ 3CO(g) CH3OCH3(g)+ CO2
(g)的ΔH= ___________;
CH3OCH3(g)+ CO2
(g)的ΔH= ___________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
⑷ 已知反应②2CH3OH(g) CH3OCH3(g)+ H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+ H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
|
物质 |
CH3OH |
CH3OCH3 |
H2O |
|
浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
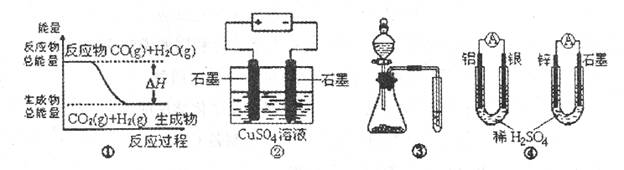
 A.图①表示C0(g)+H2O(g) CO2(g)十H2(g)是放热反应
A.图①表示C0(g)+H2O(g) CO2(g)十H2(g)是放热反应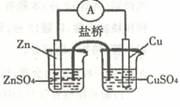 D.0.1mol CH4所含的电子数为NA
D.0.1mol CH4所含的电子数为NA