8.下列是某同学对相应反应的离子方程式所作的评价,其中合理的是

 w_w w. k#s5_u.c o*
w_w w. k#s5_u.c o*
|
编号 |
化学反应 |
离子方程式 |
评价 |
||
|
A |
碳酸钙与醋酸反应 |
CO32-+2CH3COOH = CO2↑+H2O+2CH3COO- |
错误,碳酸钙是弱电解质,不应写成离子形式 |
||
|
B |
甲醛和足量银氨溶液充分反应 |
HCOO |
正确 |
||
|
C |
NaHSO3溶液的水解 |
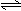 HSO3-+H2O SO32-+H3O+ HSO3-+H2O SO32-+H3O+ |
错误,水解方程式写成了电离方程式 |
||
|
D |
等物质的量的FeBr2和Cl2反应 |
2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
错误,Fe2+与Br-的物质的量之比与化学式不符 |
5.下述实验不能达到预期目的的是

 w_w w. k#s5_u.c o*
w_w w. k#s5_u.c o*
|
|
实验内容 |
实验目的 |
|
A |
将AlCl3溶液蒸干灼烧 |
制备Al2O3 |
|
B |
向淀粉水解后的溶液中,依次加入NaOH溶液、新制Cu(OH)2,共热 |
探究水解产物的还原性 |
|
C |
向某溶液中加入稀硫酸,将产生的气体通入澄清石灰水 |
检验该溶液中是否含有CO32- |
|
D |
向H2O2溶液中滴加少量FeCl3溶液 |
探究催化剂对化学反应速率的影响 |
29.(6分)海水中含有多种盐类物质,在一定温度下将海水浓缩,其间会不断有晶体析出,且海水的密度逐渐增大,下表为一定温度下不同密度(g/mL)的海水中几种盐类的含量(g/L)。回答下列问题:
|
海水密度(g/mL) |
CaSO4 (g/L) |
NaCl (g/L) |
MgCl2 (g/L) |
MgSO4 (g/L) |
NaBr (g/L) |
|
1.13 |
0.56 |
|
|
|
|
|
1.20 |
0.91 |
|
|
|
|
|
1.21 |
0.05 |
3.26 |
0.004 |
0.008 |
|
|
1.22 |
0.015 |
9.65 |
0.01 |
0.04 |
|
|
1.26 |
0.01 |
2.64 |
0.02 |
0.02 |
0.04 |
|
1.31 |
|
1.40 |
0.54 |
0.03 |
0.06 |
(1)在该温度下恒温蒸发海水时,海水的密度从1.13 g/mL增大到1.21 g/mL时是否有硫酸钙析出? ▲
(2)恒温下,当蒸发1 m3密度为1.22g/mL的海水达到密度为1.26g/mL时,析出MgSO4的质量为 ▲ kg,析出NaCl的质量为 ▲ kg。
 2010学年温州中学高三10月份月考
2010学年温州中学高三10月份月考
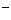 +NH
+NH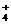 +2Ag↓+H2O
+2Ag↓+H2O
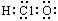 A.质量数为37的氯原子:
A.质量数为37的氯原子: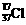 B.次氯酸分子的电子式:
B.次氯酸分子的电子式: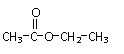
 Al(OH)3
Al(OH)3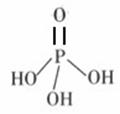 ⑵含0.300mol H3PO4的水溶液滴加到含0.500mol Ca(OH)2的悬浮液中,反应恰好完全,生成l种难溶盐和16.2g H2O。该难溶盐的化学式可表示为
。
⑵含0.300mol H3PO4的水溶液滴加到含0.500mol Ca(OH)2的悬浮液中,反应恰好完全,生成l种难溶盐和16.2g H2O。该难溶盐的化学式可表示为
。