0 42231 42239 42245 42249 42255 42257 42261 42267 42269 42275 42281 42285 42287 42291 42297 42299 42305 42309 42311 42315 42317 42321 42323 42325 42326 42327 42329 42330 42331 42333 42335 42339 42341 42345 42347 42351 42357 42359 42365 42369 42371 42375 42381 42387 42389 42395 42399 42401 42407 42411 42417 42425 447348
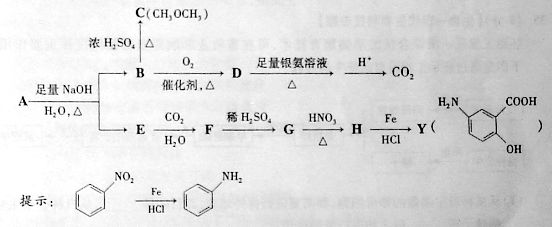
 溶液反应,D中官能团的名称是____ __,B
溶液反应,D中官能团的名称是____ __,B C的反应类型是___
_。
C的反应类型是___
_。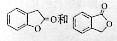 ,鉴别I和J的试剂为__
___。
,鉴别I和J的试剂为__
___。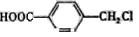 制得,写出K在浓硫酸作用下生成的聚合物的结构简式__________ _____。
制得,写出K在浓硫酸作用下生成的聚合物的结构简式__________ _____。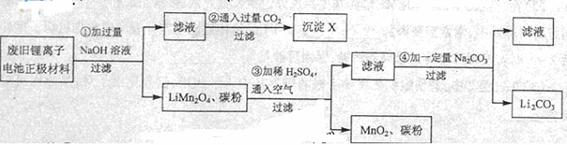
 II 2HI H2+I2
II 2HI H2+I2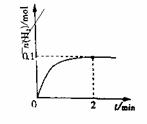 (2)一定温度下,向1L密闭容器中加入1molHI(g),
(2)一定温度下,向1L密闭容器中加入1molHI(g),