34、(10分)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可
以衡量化学键的强弱,也可以估算化学反应的反应热(△H),化学反应的△H等于反应中断
裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
|
键能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)
SiC______Si;SiCl4_________SiO2
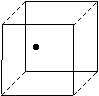
(2)右图立方体中心的“●”表示硅晶体中的一个原子,请在立方体
的顶点用“●”表示出与之紧邻的硅原子。
(3)工业上用高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)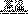 Si(s)+4HCl(g)
Si(s)+4HCl(g)
该反应的反应热△H=_____________kJ/mol
32、(12分)右表是元素周期表的一部分.
族
 周期 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
1 |
① |
|
|||||
|
2 |
② |
③ |
|
|
④ |
⑤ |
|
|
3 |
⑥ |
⑦ |
⑧ |
|
|
⑨ |
⑩ |
(1)表中元素⑩的氢化物的电子式为 ,此氢化物的还原性比元素⑨的氢化物的
还原性 (填强或弱)
(2)⑥的单质在⑤的单质中燃烧产物的电子式为
(3)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似
的性质。写出元素③的氢氧化物与NaOH溶液反应的化学方程式
;
(4)两种短期元素组成的常见化合物中,原子个数比为1︰3,若两种元素原子序数分别为
a和b,则a和b的关系可能是(填序号)_________________________
①a=b+5 ②a+b=30 ③a+b=8 ④a=b+8 ⑤a=b+1
(5)用电子式表示表中①⑨两元素形成化合物的过程
。