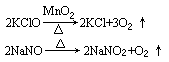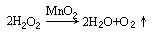1.NA代表阿伏加德罗常数的值,下列说法正确的是 ( )
A.标准状况下,11.2L四氯化碳所含分子数为0.5NA
B.0.1L 3mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3NA
C.7.8g Na2O2中阴、阳离子总数为0.4NA
D.4.5g SiO2晶体中含有的硅氧键数目为0.3NA
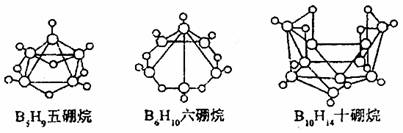 2.2008年北京奥运会主体育场的外形好似“鸟巢”(The Bird Nest)。有一类硼烷也好似鸟巢,故称为巢式硼烷。巢式硼烷除B10H14不与水反应外,其余均易与水反应生成氢气和硼酸,硼烷易被氧化。下图是三种巢式硼烷,有关说法正确的是 ( )
2.2008年北京奥运会主体育场的外形好似“鸟巢”(The Bird Nest)。有一类硼烷也好似鸟巢,故称为巢式硼烷。巢式硼烷除B10H14不与水反应外,其余均易与水反应生成氢气和硼酸,硼烷易被氧化。下图是三种巢式硼烷,有关说法正确的是 ( )
|
B.2B5H9+12O2 5B2O3+9H2O,1mol B5H9完全燃烧转移25mol电子
C.8个硼原子的剿式硼烷化学式应为B8H10
D.硼烷与水反应是非氧化还原反应
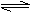 已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是 ( )
已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是 ( )