摘要:18.铜和稀硝酸在常温常压下反应.开始时反应非常慢.但是随着反应的进行.反应速率不断地加大.某校合作学习小组的同学拟探究影响其速率的主要因素. (1)甲同学认为是生成的Cu2+对该反应起催化作用.欲验证其假设是否正确.其实验方法是: . (2)乙同学依据铜和硝酸是放热反应.拟研究温度升高是否为该反应速度率不断加大的主要原因.实验结果如下: 由此可得到的结论是 . (3)丙同学查阅文献.得知稀硝酸与铜反应.还原产物起始也是NO2.NO2对该反应起催化作用.通过下列装置验证.实验发现左侧3min后开始大量产生气泡.右侧40min内无明显变化. ①氢氧化钠溶液的作用是 . ②该学生设计在左侧加的是2mol·L-1 HNO3溶液.右侧加的是1.2 mol·L-1 硝酸.左侧浓度稍偏小.这样设计主要是考虑到 . (4)丁同学与丙同学交流后.他将实验改进为:在试管中加入3mL2mol·L-1 HNO3并放入铜片.然后加入几粒NaNO2晶体.发现只需1秒钟.铜片表面就开始产生气泡.由丁的实验可得出的结论是: .
网址:http://m.1010jiajiao.com/timu3_id_421227[举报]
铜和稀硝酸在常温常压下反应,开始时反应非常慢,但是随着反应的进行,反应速率不断地加大。某校合作学习小组的同学拟探究影响其速率的主要因素。
(1)甲同学认为是生成的Cu2+对该反应起催起作用,欲验证其假设是否正确,其实验方法是_________________________________。
(2)乙同学依据铜和硝酸是放热反应,拟研究温度升高是否为该反应速度率不断加大的主要原因,实验结果如下
(1)甲同学认为是生成的Cu2+对该反应起催起作用,欲验证其假设是否正确,其实验方法是_________________________________。
(2)乙同学依据铜和硝酸是放热反应,拟研究温度升高是否为该反应速度率不断加大的主要原因,实验结果如下
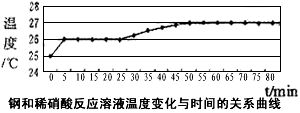
由此可得出的结论是:_____________________________。
(3)丙同学查阅文献,得知稀硝酸与铜反应,还原产物起始也是NO2,NO2对该反应起催化作用。通过下列装置验证。实验发现左侧3min后开始大量产生气泡,右侧40min内无明显变化。
(3)丙同学查阅文献,得知稀硝酸与铜反应,还原产物起始也是NO2,NO2对该反应起催化作用。通过下列装置验证。实验发现左侧3min后开始大量产生气泡,右侧40min内无明显变化。
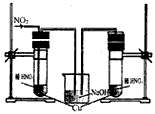
①氢氧化钠溶液的作用是_______________________。
②该学生设计在左侧加的是2mol·L-1 HNO3溶液,右侧加的是2.2mol·L-1硝酸。左侧浓度稍偏小,这样设计主要是考虑到______________________。
(4)丁同学与丙同学交流后,他将实验改进为:在试管中加入3mL2mol·L-1HNO3并放入铜片,然后加入几粒NaNO2晶体,发现只需1秒钟,铜片表面就开始产生气泡。由丁的实验可得出的结论是_________________________________。
查看习题详情和答案>>
②该学生设计在左侧加的是2mol·L-1 HNO3溶液,右侧加的是2.2mol·L-1硝酸。左侧浓度稍偏小,这样设计主要是考虑到______________________。
(4)丁同学与丙同学交流后,他将实验改进为:在试管中加入3mL2mol·L-1HNO3并放入铜片,然后加入几粒NaNO2晶体,发现只需1秒钟,铜片表面就开始产生气泡。由丁的实验可得出的结论是_________________________________。