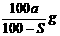4.(如皋市2010届高三综合测试)乙醇是重要的饱和一元醇,在有机和无机反应中都有应用。
(1)在酯化反应的实验中,乙酸、乙醇的用量和平衡时乙酸乙酯的生成量如下表:
|
反应 |
乙醇/kmol |
乙酸/kmol |
乙酸乙酯/kmol |
|
1 |
2 |
2 |
1.33 |
|
2 |
3 |
2 |
1.57 |
|
3 |
4 |
2 |
X |
|
4 |
5 |
2 |
1.76 |
① 由表中数据推测,数值X的范围是__________。推断的依据为
② 假设乙醇的价格为500元/kmol,乙酸乙酯的价格为1600元/kmol,同反应2相比,反应3的经济效益_______ (填:“增加”或 “减少”)
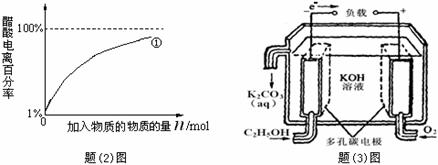
(2)10.00 mL 0.10 mol·L-1的稀醋酸中存在着平衡:CH3COOH CH3COOˉ+H+。①向稀醋酸中不断加水②向稀醋酸中慢慢滴加0.10 mol·Lˉ1的稀氢氧化钠溶液。①中醋酸电离百分率的变化图线已画出,请你在上左图中画出②过程中醋酸电离百分率的变化图线。
CH3COOˉ+H+。①向稀醋酸中不断加水②向稀醋酸中慢慢滴加0.10 mol·Lˉ1的稀氢氧化钠溶液。①中醋酸电离百分率的变化图线已画出,请你在上左图中画出②过程中醋酸电离百分率的变化图线。
(3)乙醇是一种可再生能源,可用它来制成燃料电池(如上右图),试写出其负极的电极反应式 。
 (1)①1.57<X<1.76(2分),在乙酸物质的量相同条件下,
(1)①1.57<X<1.76(2分),在乙酸物质的量相同条件下,
增加乙醇的物质的量平衡向右移动,乙酸乙酯的物质的
量增加,减少乙醇的物质的量平衡向左移动,乙酸乙酯
的物质的量减少(2分);
② 减少(2分)
(2)如右图(2分)
(3)C2H5OH-12eˉ + 16OHˉ = 2CO32ˉ+ 11H2O(2分)
2.(姜堰市罗塘中学2009-2010学年第一学期期中考试高三化学试题)下列实验能达到预期目的的是
|
序号 |
实验操作 |
实验目的 |
|
A |
浓、稀HNO3分别与Cu反应 |
比较浓、稀HNO3的氧化性强弱 |
|
B |
金属钠投入硫酸铜溶液中 |
置换出铜 |
|
C |
把铜和银用导线连接后插入稀硫酸中 |
组成原电池验证铜比银活泼 |
|
D |
用等浓度的盐酸、碳酸氢钠两溶液混合反应 |
比较盐酸、碳酸的酸性强弱 |
12.(江苏省黄桥中学2010届高三期中考试(化学))粗盐提纯的研究。
[有关资料]
|
化学式 |
CaCO3 |
CaSO3 |
CaC2O4 |
Mg(OH)2 |
|
Ksp |
4.96×10-9 |
4.96×10-9 |
2.34×10-9 |
5.61×10-12 |
某研究性学习小组对粗盐的提纯和检验进行研究,并提出一些新的方案。已知该粗盐样品中主要含有不溶性杂质、Mg2+、Ca2+等(忽略SO42-的存在),该小组设计流程如下:
 [设计除杂过程]
[设计除杂过程]
(1)操作①中需要使用的玻璃仪器有 、 。操作②的名称为 。
(2)混合液A的主要成分是 。(填化学式)
[检验除杂效果]
(3)为检验溶液B中Mg2+、Ca2+是否除尽,通常分别取少量溶液B于两支试管中,进行如下实验:
步骤一:检验Mg2+是否除尽。向其中一支试管中加入 溶液(填化学式),看是否有沉淀生成。
步骤二:检验Ca2+是否除尽。向另一支试管中加入某溶液,看是否有沉淀生成。效果最好的是 (填字母)。A.Na2CO3 B.Na2SO3 C.Na2C2O4
[获取纯净食盐]
(4)对溶液B加热并不断滴加6 mol·L-1的盐酸溶液,同时用pH试纸检测溶液,直至pH=2时停止加盐酸,得到溶液C,该操作的目的是 。
(5)将溶液C倒入 (填仪器名称)中,加热蒸发并用玻璃棒不断搅拌,直到 时(填现象),停止加热。
[问题讨论]
(6)在除杂过程中,向粗盐悬浊液中加混合液A,该操作中控制溶液pH=12可确保Mg2+除尽,根据提供的数据计算,溶液B中Mg2+物质的量浓度将被控制在 以下。
(1)烧杯、玻璃棒,过滤 (2分)
(2)NaOH、Na2CO3 (2分)
(3)NaOH C (2分)
(4)除去NaOH和Na2CO3 (2分)
(5)蒸发皿 蒸发皿中有大量固体析出(2分)
(6)5.61×10-8 mol·L-1。(2分)
9.(江苏省海安高级中学2010届高三10月月考(化学))下列物质的分类正确的是
|
|
混合物 |
非电解质 |
碱 |
酸式盐 |
|
A |
漂白粉 |
Cl2 |
氨水 |
NaHCO3 |
|
B |
福尔马林 |
苯 |
Cu2(OH)2CO3 |
明矾 |
|
C |
胆矾 |
SO2 |
纯碱 |
NH4Cl |
|
D |
食醋 |
C2H5OH |
苛性钾 |
NaHSO4 |
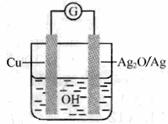 (江苏省赣榆一中2010届高三12月阶段考试化学)普通水泥在固化过程中自由水分子减少并形成碱性溶液。根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为:2Cu+ Ag2O= Cu2O 十2Ag下列有关说法正确的是
(江苏省赣榆一中2010届高三12月阶段考试化学)普通水泥在固化过程中自由水分子减少并形成碱性溶液。根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为:2Cu+ Ag2O= Cu2O 十2Ag下列有关说法正确的是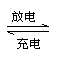
 AsO33ˉ+I2+H2O设计成如右图
AsO33ˉ+I2+H2O设计成如右图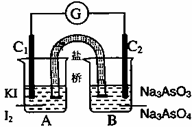 所示的电化学装置,其中C1、C2均为石墨棒。甲、乙两
所示的电化学装置,其中C1、C2均为石墨棒。甲、乙两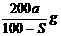 B.
B. 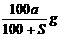 C.
C.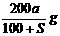 D.
D.