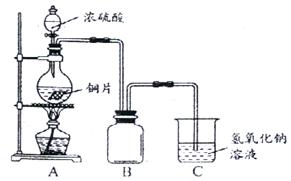
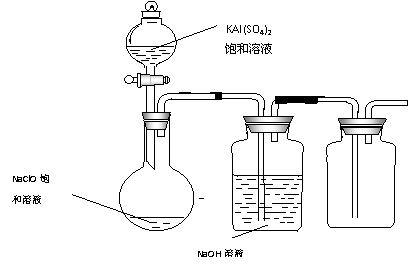
17.为提纯下列物质(括号中为杂质),所选除杂试剂和分离方法都正确的是 ( )
|
选项 |
被提纯的物质(杂质) |
除杂试剂 |
分离方法 |
|
A |
H2S(H2O) |
浓硫酸 |
洗气 |
|
B |
H2O(Br2) |
CCl4 |
分液 |
|
C |
KCl固体(I2) |
KOH溶液 |
加热 |
|
D |
苯(苯酚) |
浓溴水 |
过滤 |
 2Z(g),若X、Y、Z的起始浓度分别为c
2Z(g),若X、Y、Z的起始浓度分别为c 、c
、c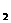 、c
、c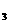 (均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是
( )
(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是
( ) 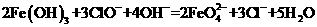
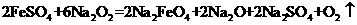
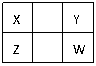 已知X、Y、Z、W四种短周期元素(均非稀有气体元素)在周期表中的相对位置如右图所示,下列说法正确的是
已知X、Y、Z、W四种短周期元素(均非稀有气体元素)在周期表中的相对位置如右图所示,下列说法正确的是