33.(16分)分子式为C12H14O2的F有机物广泛用于香精的调香剂。为了合成该物,某实验室的科技人员设计了下列合成路线:
|
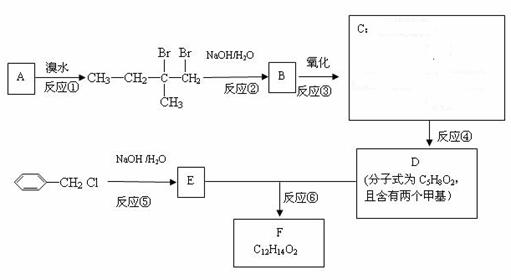
试回答下列问题:
(1)A物质在核磁共振氢谱中能呈现 种峰;
(2)C物质的官能团名称______;
(3)上述合成路线中属于取代反应的是 (填编号);
(4)写出反应④、⑥的化学方程式(不要求写出反应条件):
④ ,⑥ ;
(5)写出E属于芳香族化合物的2种同分异构体(不含E)的结构简式:
 。
。
广东省汕头市潮阳区2010届高三上学期统考
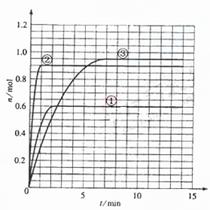
32. (16分) 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
(16分) 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
 (1)根据下表中数据,在由图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
(1)根据下表中数据,在由图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
|
t/min |
X/mol |
Y/mol |
Z/mol |
|
0 |
1.00 |
1.00 |
0.00 |
 1 1 |
0.90 |
0.80 |
0.20 |
|
3 |
0.75 |
0.50 |
0.50 |
|
5 |
0.65 |
0.30 |
0.70 |
|
9 |
0.55 |
0.10 |
0.90 |
|
10 |
0.55 |
0.10 |
0.90 |
|
14 |
0.55 |
0.10 |
0.90 |
 (2)体系中发生反应的化学方程式是
。
(2)体系中发生反应的化学方程式是
。
(3)列式计算该反应在0-3min时间内产物Z的平均反应速率: 。
(4)该反应达到平衡时反应物X的转化率α等于 。
(5)如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如右图所示)则曲线①、②、③所对应的实验条件改变分别是:① ② ③ 。
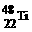 和
和 的说法中正确的是
的说法中正确的是
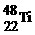 和
和 4Fe(OH)3+8OH-+3O2 △H=? 。
4Fe(OH)3+8OH-+3O2 △H=? 。