17. 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
 C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3 kJ•mol-1,ΔS=+133.7J•(K•mol)
-1
C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3 kJ•mol-1,ΔS=+133.7J•(K•mol)
-1
①该反应能否自发进行与 有关;
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是 (填字母,下同)。
a.容器中的压强不变 b.1 mol H-H键断裂的同时断裂2 molH-O键
c.v正(CO) = v逆(H2O) d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
 CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
|
实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所 需时间/min |
||
|
H2O |
CO |
H2 |
CO |
|||
|
1 |
650 |
2 |
4 |
1.6 |
2.4 |
5 |
|
2 |
900 |
1 |
2 |
0.4 |
1.6 |
3 |
|
3 |
900 |
a |
b |
c |
d |
t |
①实验1中以v(CO2) 表示的反应速率为 。
②该反应的逆反应为 (填“吸”或“放”)热反应
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是 (用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:
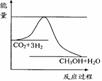 CO2(g)+3H2(g)
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ,右下图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol
CO2和3mol H2,下列措施中能使c (CH3OH)增大的是___________。
CH3OH(g)+H2O(g) ,右下图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol
CO2和3mol H2,下列措施中能使c (CH3OH)增大的是___________。
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来 d.再充入1mol CO2和3mol H2
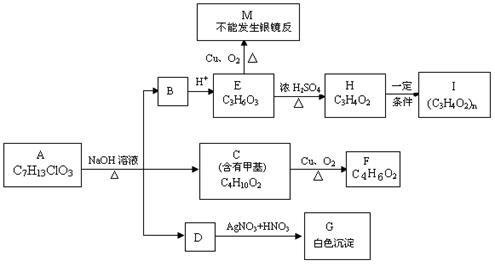
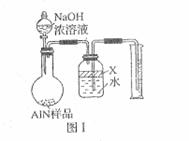 实验有关操作:
实验有关操作: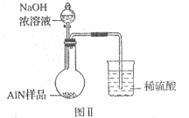 (6)有人建议改用图Ⅱ装置进行同样实验,欲通过测定
(6)有人建议改用图Ⅱ装置进行同样实验,欲通过测定
 5NaCl + NaClO3 + 3H2O
5NaCl + NaClO3 + 3H2O
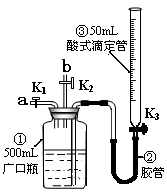 (1)向广口瓶①中通入NO并测定NO的体积
(1)向广口瓶①中通入NO并测定NO的体积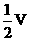 时,则广口瓶①的气体体积为
;
时,则广口瓶①的气体体积为
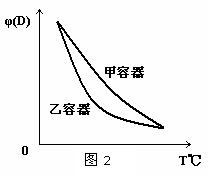
; C(g)+3D(g)△H<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
C(g)+3D(g)△H<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。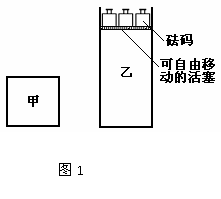
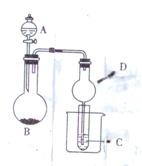 用右图装置进行实验,将液体A逐渐加入到固体B中,下列叙述正确的是
用右图装置进行实验,将液体A逐渐加入到固体B中,下列叙述正确的是