48.用Cl2消毒饮用水已有百年历史,近年发现这种方法可能对人体有害。世界环保联盟推荐采用广谱高效消毒剂ClO2。ClO2是黄绿色易爆物,沸点9.90℃。制备ClO2的方法之一表述为: [ ]KClO3 + [ ] HCl(浓) == [ ] KCl + [ ] ClO2↑ + [ ] Cl2↑ + [ ] (1)请完成该化学方程式并配平(未知物化学式和系数填入框内)
(2)盐酸在反应中显示出来的性质是_______(填写编号,多选倒扣)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)产生0.1molCl2,则转移的电子的物质的量为_________mol.
(4)与传统消毒剂Cl2比较,ClO2消毒的效率(以单位质量得到的电子数表示)是Cl2的___倍。
49下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|
(1)④、⑤、⑥的原子半径由大到小的顺序为[填元素符号]_________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是[填化学式]_____________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(4) 由②和④组成,且②和④的质量比为3∶8的化合物的结构式是 ,
该物质与⑤的同周期相邻主族元素的单质反应的化学方程式为
(5) ⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为
。
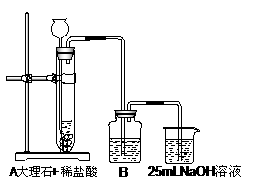 某实验小组拟用50mLNaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通人的CO2气体过量生成NaHCO3,设计了如下实验步骤:
某实验小组拟用50mLNaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通人的CO2气体过量生成NaHCO3,设计了如下实验步骤: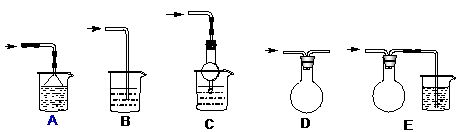





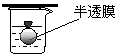
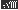
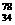 Se和
Se和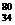 Se的说法正确的是[ ]
Se的说法正确的是[ ]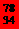 Se和
Se和 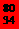 Se互为同位素
Se互为同位素