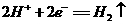0 41188 41196 41202 41206 41212 41214 41218 41224 41226 41232 41238 41242 41244 41248 41254 41256 41262 41266 41268 41272 41274 41278 41280 41282 41283 41284 41286 41287 41288 41290 41292 41296 41298 41302 41304 41308 41314 41316 41322 41326 41328 41332 41338 41344 41346 41352 41356 41358 41364 41368 41374 41382 447348
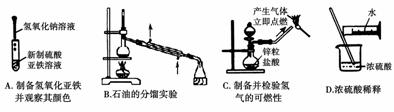 根据实验目的判断下列实验操作或装置正确的是
根据实验目的判断下列实验操作或装置正确的是  的平衡常数为K
的平衡常数为K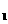 ,反应②
,反应② ,的平衡常数为
,的平衡常数为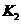 ,回答下列各小题。
,回答下列各小题。 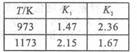 (1)反应①的平衡常数K
(1)反应①的平衡常数K 的值如右表所示。现有反应③:
的值如右表所示。现有反应③: 这是一个 (填“吸热”
这是一个 (填“吸热”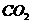 溶液中
溶液中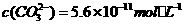 ,
,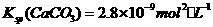 向1.0mol·L
向1.0mol·L 的CaCl2溶液中通入
的CaCl2溶液中通入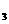 沉淀? ,理论依据是
。
沉淀? ,理论依据是
。
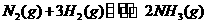 ,若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂 反应的△H(填“增大”、“减小”或“不改变”)。
,若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂 反应的△H(填“增大”、“减小”或“不改变”)。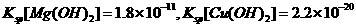
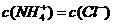 ,则溶液显 性(填“酸”、“碱”或“中”);且
,则溶液显 性(填“酸”、“碱”或“中”);且 =
0.01(填
=
0.01(填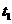 时开始加热,
时开始加热,
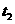 时间
时间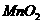 、S,设计了以下实验流程图:
、S,设计了以下实验流程图: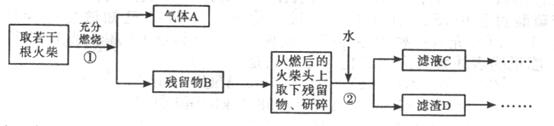
 请回答以下问题:
请回答以下问题: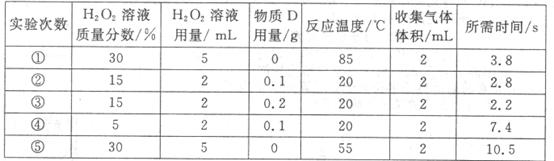
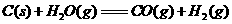
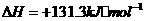
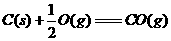
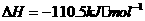
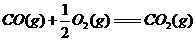
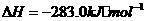
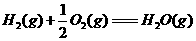
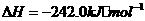
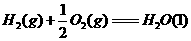

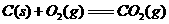
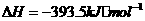
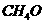 );②甲醛(CH2O);③甲酸(
);②甲醛(CH2O);③甲酸(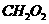 );④乙酸(
);④乙酸(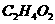 )。试分析当
)。试分析当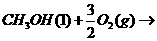
 (1)
(1)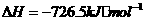 ,结合上述关系式试写出由
,结合上述关系式试写出由 、
、 生成甲醇的热化学方程式:
。
生成甲醇的热化学方程式:
。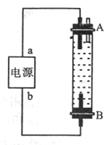 该电池放电时,负极电极反应式为
。
该电池放电时,负极电极反应式为
。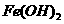 的
的