28. 丙烯是石油化工的重要原料,一定条件下可发生下列转化:
已知:

(1)A的结构简式为 。
(2)写出反应类型:反应① ;反应④ 。
(3)D与足量乙醇反应生成E的化学方程式为 。
(4) 与足量NaOH乙醇溶液反应的化学方程式为
。
与足量NaOH乙醇溶液反应的化学方程式为
。
(5)B有多种同分异构体,写出其中既能发生银镜反应,又能发生酯化反应的2种同分异构体的结构简式: 、 。
|
29. 常温下,向25 mL 0.1 mol/L MOH溶液中逐滴加入0.2 mol/L HA溶液,曲线如图所示(体积变化忽略不计)。回答下列问题: (1)由图确定MOH为_____碱(填“强”或“弱”),理由是_______________________________。 (2)MOH与HA恰好完全反应时,溶液呈_____性(填 |
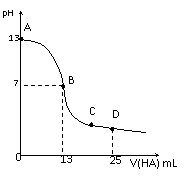  |
“酸”、“碱”或“中”),理由是(用离子方程式表示)_______;此时,混合溶液中由水电离出的c(H+)___ 0.2 mol/L HA溶液中由水电离出的c(H+)(填“>”“<”或“=”)。
(3)分别写出B、C两点,混合溶液中各离子浓度的大小关系
B点______________;C点_____________;
(4)D点时,溶液中c(A-)+c(HA)________2 c(M+)(填“>”“<”或“=”);若此时测得混合溶液的pH = 3,则 c(HA) + c(H+) = __________mol/L。
27. 元素周期表是指导我们系统学习化学的重要工具。
|
(1)元素周期表中每种元素的具体信息如右图例示: 从中可以获得氟元素的有关信息有(至少写出两点)_____________。 (2)元素周期表中,相邻近的元素在结构和性质上有许多相似之处。 |
 |
①如,第二周期的碳、氮、氧、氟都可以形成氢化物,氧元素的氢化物除H2O外,还有H2O2;碳元素的氢化物除CH4外,还有C2H6等;与之相似的氮元素的氢化物除NH3外,还有_____(填化学式),其沸点比液氨_____ (填“高”或“低”),稳定性比氨_____( 填“好”或“差”),该氢化物与足量盐酸反应的化学方程式为_____________。
②氮原子间也可形成链状结构,假设氮原子间只以N-N键形式连接,并形成氢化物,则该系列氢化物的通式为___________________。
|
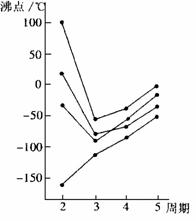
(3)元素周期表中,相邻近的元素在结构和性质上也有递变之处。右图中每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化(每个小黑点代表一种氢化物): ①其中a点代表的是__________(填化学式),该元素在元素周期表中的位置是 。 ②非金属气态氢化物的沸点与_____________有关,它们之间的关系为_______________________。 |
|
(4)下列关于元素周期表性质的说法中正确的是_________(填写编号)
a. ⅠA族元素的金属性比ⅡA族元素的金属性强
b. ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
c. 同周期非金属氧化物对应的水化物的酸性从左到右依次增强
d. 第三周期元素的离子半径从左到右逐渐减小
26. M是由两种阳离子、一种阴离子组成的化合物。某学习小组的同学对该化合物进行了研究。
(1)取M的样品配成溶液,溶液呈棕黄色。将溶液分成三份,做了下列3组实验,分别检出A、B、C三种离子。请完成下表中的空格:
|
组别 |
操作 |
实验现象 |
检出的离子 |
|
第1组 |
加入足量的NaOH溶液并加热 |
产生的气体使湿润的红色石蕊试纸变蓝 |
A:_________ |
|
第2组 |
加入KSCN溶液 |
溶液呈_________色 |
B:Fe3+ |
|
第3组 |
加入___________和BaCl2溶液 |
有白色沉淀生成 |
C:SO42- |
(2)取9.640 g M配成溶液,加入足量的NaOH溶液,得到红褐色沉淀,将沉淀过滤、洗涤、灼烧,冷却后称量。经过4次灼烧、称量得到的红棕色固体的质量数据如下表。
|
|
第1次 |
第2次 |
第3次 |
第4次 |
|
质量(g) |
1.630 |
1.610 |
1.600 |
1.600 |
 ① 灼烧和称量时需用右图所示的仪器,它们的名称分别是:
① 灼烧和称量时需用右图所示的仪器,它们的名称分别是:
Ⅰ____________、Ⅱ____________。
② 此红棕色固体为_____(填化学式),其准确质量为____g。
③另取9.640 g M配成溶液,加入足量的BaCl2溶液,得到白色沉淀,将沉淀过滤、洗涤,干燥,称得其质量为9.320 g。由此小组同学推算出M的化学式为__________。
(3)将步骤(2)灼烧所得红棕色固体与铝粉按一定比例均匀混合,所得混合物叫做________剂。该混合物在一定条件下可以发生剧烈的化学反应并放出大量热,写出该反应的化学方程式:______________,工业上利用该类反应来______(写一用途)。
25. 合成氨工业对国民经济和社会发展具有重要的意义,合成氨气所需的氢气可以由水煤气分离得到。涉及反应信息如下:
反应①:C(s)+H2O(g) 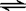 H2(g) + CO(g) 平衡常数K1
H2(g) + CO(g) 平衡常数K1
反应②:平衡常数 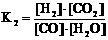
(1)写出K1的表达式 ;反应②的化学方程式为 。
(2)在恒容时,对反应①,不能判断该反应达到化学平衡状态的是 (填编号)。
a. 容器中压强不变 b. 混合气体中CO浓度不变
c. υ(H2)正=υ(H2O)逆 d. c(H2O) = c(CO)
(3)将一定量的H2O(g)和CO(g)分别通入到体积为1L的密闭容器中,在不同条件下进行反应,得到以下三组数据:
|
实验组别 |
温度/℃ |
起始量/mol |
平衡量/mol |
达平衡所需时间/min |
||
|
H2O |
CO |
H2 |
CO |
|||
|
1 |
650 |
1 |
2 |
0.8 |
1.2 |
5 |
|
2 |
900 |
0.5 |
1 |
0.2 |
0.8 |
3 |
|
3 |
T |
a |
b |
c |
d |
t |
(I)实验1中,用CO2表示反应开始到平衡的平均反应速率为 ;
(II)在实验3,当a=0.5、b=1时,要使c、d数据与实验2相同,且t<3,可以采取的措施为 (填编号)
a. 其它条件不变,温度T<900℃ b. 其它条件不变,温度T>900℃
c. 充入一定量氖气 d. 使用高效催化剂
(III)对于反应②,当升高温度时K2 (填“增大”、“减小”或“不变”)。
23. [实验]向少量的Mg(OH)2悬浊液中,加入适量的饱和氯化铵溶液,固体完全溶解。
为解释这一实验现象,同学们开展热烈讨论:
(1)大家一致认为氢氧化镁固体溶于水:Mg(OH)2(固) 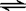 Mg(OH)2(aq)
Mg(OH)2(aq)
由于氢氧化镁是电解质,因此会发生电离①___________________(用方程式表示)
(2)甲同学认为:由于NH4Cl溶液显酸性,H+与OH-反应生成水,导致了①平衡右移,沉淀溶解。请用相关方程式表示NH4Cl溶液显酸性的原因_________________;
乙同学解释:由于NH4Cl电离出的NH4+与Mg(OH)2电离出的OH-结合,生成了弱的电解质NH3·H2O,导致了①平衡右移,Mg(OH)2沉淀溶解。
|
(3)为了验证哪位同学的解释合理 ①丙同学通过查阅数据(见右图),选用下列试剂中的一种进行确定,他选用的试剂是___________(填写编号)。 a. NH4NO3 b. CH3COONH4 c. Na2CO3 d. NH3·H2O |
|
并说明丙同学选择这一试剂的理由____________________________________。
②丙同学将所选试剂滴入Mg(OH)2的浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理________(填“甲”或“乙”);完成NH4Cl饱和溶液使Mg(OH)2悬浊溶解的离子方程式_____________________________。
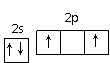
 ,你认为_______(填“正确”或“不正确”),若不正确,请写出正确的轨道表示式__________(若正确,此空不答)。
,你认为_______(填“正确”或“不正确”),若不正确,请写出正确的轨道表示式__________(若正确,此空不答)。