4. 下表为关于农作物A、B在相同土壤中N、P、K三要素肥效实验的结果记录(“+”表示施肥,“-”表示未施肥)。据此结果得出的正确结论是( )
下表为关于农作物A、B在相同土壤中N、P、K三要素肥效实验的结果记录(“+”表示施肥,“-”表示未施肥)。据此结果得出的正确结论是( )
|
|
农作物A |
农作物B |
|||||||||
|
肥料 成分 |
N |
+ |
- |
+ |
+ |
- |
+ |
- |
+ |
+ |
- |
|
P |
+ |
- |
+ |
- |
+ |
+ |
- |
+ |
- |
+ |
|
|
K |
+ |
- |
- |
+ |
+ |
+ |
- |
- |
+ |
+ |
|
|
产量 |
100 |
54 |
83 |
65 |
100 |
100 |
34 |
70 |
55 |
40 |
A.对农作物A来说,N是非必需元素
 B.农作物A可能是豆科植物
B.农作物A可能是豆科植物
 C.对农作物B来说,3种元素中K元素最重要
C.对农作物B来说,3种元素中K元素最重要
 D.两种农作物对N、P、K的需求量基本相同
D.两种农作物对N、P、K的需求量基本相同
22.(10分)
浓H2SO4和木炭在加热时发生反应的化学方程式是
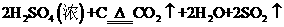
请从下图中选择所需用的仪器(可重复选用)组成一套进行该反应并检出反应产物的装置。现提供浓H2SO4、木炭和酸性KMnO4溶液,其他固、液试剂自选。(连接和固定仪器用的玻璃管、胶管、铁管、铁架台及加热装置等均略去)
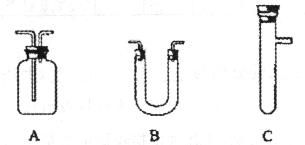
将所选的仪器按连接顺序由上至下依次填入下表,并完成表格相应内容
|
所选用仪器的名称(填字母) |
加入的试剂名称 |
该装置作用 |
|
|
|
反应器(或发生气体) |
|
|
|
检出水 |
|
|
|
检出二氧化硫 |
|
|
酸性高锰酸钾溶液 |
|
|
|
|
检出二氧化碳 |

 (6分)
(6分)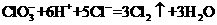 ),再立即将表面皿盖好,试描述各处反应的现象,并写出相应的离子反应方程式。
),再立即将表面皿盖好,试描述各处反应的现象,并写出相应的离子反应方程式。 




