摘要:下列有可能在蓝藻细胞中发生的过程为( ) ①N2→NH3 ②氨基酸→多肽 ③NO→N2 ④CO2+H2O→(CH2O)+O2 ⑤NH3→NO ⑥C6H12O6+O2→CO2+H2O A.①②④⑤⑥ B.③④⑤ C.② D.①②④⑥
网址:http://m.1010jiajiao.com/timu3_id_407089[举报]
 据《华盛顿邮报》报道,美国食品与药物管理局近期公布了一份草拟的评估报告,指出塑料奶瓶和婴儿奶粉罐普遍存在的化学物质双酚A(如图),并不会对婴儿或成人的健康构成威胁.关于双酚A的下列说法正确的是( )
据《华盛顿邮报》报道,美国食品与药物管理局近期公布了一份草拟的评估报告,指出塑料奶瓶和婴儿奶粉罐普遍存在的化学物质双酚A(如图),并不会对婴儿或成人的健康构成威胁.关于双酚A的下列说法正确的是( )| A、该有机物属于芳香族化合物,分子式为C21H24O2 | B、该有机物分子中所有碳原子有可能在同一平面上 | C、双酚A不能使溴水褪色,但能使酸性的高锰酸钾溶液褪色 | D、双酚A的一氯取代物有三种 |
常见元素A、B、C、D,其原子结构的相关信息如下表:
请回答下列问题:
(1)A的原子结构示意图是 ;D元素位于周期表第 周期 族.
(2)在由B和A形成的众多分子中,只要B原子的成键轨道满足 (填字母序号),分子中所有的原子就有可能在同一个平面内.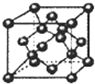
A.Sp3 或Sp2 杂化轨道 B.sp3 或sp 杂化轨道 C.sp 或sp2 杂化轨道
(3)如图,在B晶体的一个晶胞中含有 个B原子.
(4)制备C2A4的方法是用次氯酸钠(NaClO)溶液氧化过量的CA3.
①CA3分子是 (填“极性”或“非极性”)分子.
②写出制备C2A4的总反应方程式
(5)DC13晶体溶于水溶液呈酸性,其原因是(用离子方程式表示): .
查看习题详情和答案>>
| 元素 | 相关信息 |
| A | A原子的核外电子总数等于其基态电子层数 |
| B | B原子的最外层电子数是次外层电子数的2倍 |
| C | C的基态原子L电子层中有3个未成对电子 |
| D | D的外围电子层排布为(n+1)d3n(n+2)sn |
(1)A的原子结构示意图是
(2)在由B和A形成的众多分子中,只要B原子的成键轨道满足

A.Sp3 或Sp2 杂化轨道 B.sp3 或sp 杂化轨道 C.sp 或sp2 杂化轨道
(3)如图,在B晶体的一个晶胞中含有
(4)制备C2A4的方法是用次氯酸钠(NaClO)溶液氧化过量的CA3.
①CA3分子是
②写出制备C2A4的总反应方程式
(5)DC13晶体溶于水溶液呈酸性,其原因是(用离子方程式表示):
随着环保意识的增强,清洁能源越来越受人们关注.
(1)氢能在二十一世纪有可能在世界能源舞台上成为一种举足轻重的二次能源.
①硫-碘循环分解水制氢主要涉及下列反应:
I.SO2+2H2O+I2=H2SO4+2HIⅡ.2HI
H2+I2Ⅲ.2H2SO4=2SO2+O2+2H2O
分析上述反应,下列判断正确的是
a.反应Ⅲ易在常温下进行 b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O d.循环过程中产生l mol O2的同时产生1mol H2
②利用甲烷与水反应制备氢气,因原料价廉产氢率高,具有实用推广价值,已知该反应为:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ?mol-1若800℃时,反应的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4)=3.0mol?L-1;c(H2O)=8.5mol?L-1;c(CO)=2.0mol?L-1;c(H2)=2.0mol?L-1,则此时正逆反应速率的关系是v正
③实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)
CH3OH(g)分析该反应并回答下列问题:
①下列各项中,不能说明该反应已达到平衡的是
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗1mol CO,同时生成l mol CH3OH
②如图甲是该反应在不同温度下CO的转化率随时间变化的曲线.T1和T2温度下的平衡常数大小关系是K1
③已知甲醇燃料电池的工作原理如图乙所示.
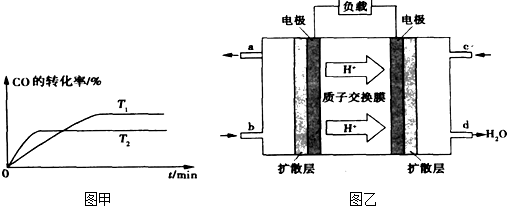
①该电池工作时,b口通入的物质为
查看习题详情和答案>>
(1)氢能在二十一世纪有可能在世界能源舞台上成为一种举足轻重的二次能源.
①硫-碘循环分解水制氢主要涉及下列反应:
I.SO2+2H2O+I2=H2SO4+2HIⅡ.2HI
| 通电 |
分析上述反应,下列判断正确的是
c
c
(填序号,下同).a.反应Ⅲ易在常温下进行 b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O d.循环过程中产生l mol O2的同时产生1mol H2
②利用甲烷与水反应制备氢气,因原料价廉产氢率高,具有实用推广价值,已知该反应为:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ?mol-1若800℃时,反应的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4)=3.0mol?L-1;c(H2O)=8.5mol?L-1;c(CO)=2.0mol?L-1;c(H2)=2.0mol?L-1,则此时正逆反应速率的关系是v正
>
>
v逆.(填“>”、“<”或“=”)③实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡
向右
向右
移动(填“向左”、“向右”或“不”);若加入少量下列固体试剂中的b
b
,产生H2的速率将增大.a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)
| 加热 |
①下列各项中,不能说明该反应已达到平衡的是
d
d
.a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗1mol CO,同时生成l mol CH3OH
②如图甲是该反应在不同温度下CO的转化率随时间变化的曲线.T1和T2温度下的平衡常数大小关系是K1
>
>
K2.(填“>”、“<”或“=”)③已知甲醇燃料电池的工作原理如图乙所示.

①该电池工作时,b口通入的物质为
CH3OH
CH3OH
,该电池正极的电极反应式为:O2+4e-+4H+=2H2O
O2+4e-+4H+=2H2O
,工作一段时间后,当6.4g甲醇(CH3OH)完全反应生成CO2时,有1.2
1.2
mol电子发生转移.
 塑料奶瓶中存在有双酚A(如图),欧盟认为含双酚A奶瓶会诱发性早熟,从2011年3月2日起,禁止含生产双酚A(BPA)的婴儿奶瓶.关于双酚A的下列说法正确的是( )
塑料奶瓶中存在有双酚A(如图),欧盟认为含双酚A奶瓶会诱发性早熟,从2011年3月2日起,禁止含生产双酚A(BPA)的婴儿奶瓶.关于双酚A的下列说法正确的是( )