摘要:19. 已知反应:BrO3一+5Br一+6H+=3Br2+3H2O.某探究学习小组利用该反应对化学反应速率与反应物浓度的关系进行探究.在20℃进行实验.得到的数据如下表: 回答下列问题: (1)反应速率V2= (2)温度对该反应的反应速率的影响符合-般规律.若在40℃下进行编号①对应浓度的实验.反应速率v . A.<4.8×1一8 mol L一1·s一1 B.2.4×1一8~4.8×10一8 mol ·L一1s一1 C.>4.8×1一8mol L一1·s 一8 D.数据不足.无法判断 (3)通过分析比较上表数据.得到的结论是 .
网址:http://m.1010jiajiao.com/timu3_id_403562[举报]
在固定体积的密闭容器中进行如下反应:2AB2(g)+B2(g)?2AB3(g).已知反应过程某一时刻AB2、B2、AB3浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,达到平衡时,浓度可能正确的是( )
| A、AB2、B2分别为0.4mol/L、0.2mol/L | B、AB2为0.25mol/L | C、AB2、AB3均为0.15mol/L | D、AB3为0.4mol/L |
在固定体积的密闭容器中进行如下反应:2SO2(g)+O2(g)?2SO3(g).已知反应过程某一时刻SO2,O2,SO3浓度(mol/L)分别为0.2,0.2,0.2,达到平衡时,浓度可能正确的是( )
| A、SO2,O2分别为0.4,0.3mol/L | B、SO2为0.25mol/L | C、SO2,SO3均为0.15mol/L | D、SO3为0.4mol/L |
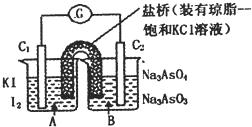 已知反应AsO43-+2I一+2H+?AsO43-+I2+H2O是可逆反应.设计如图装置(C1、C2均为石墨电极),分别进行下述操作.
已知反应AsO43-+2I一+2H+?AsO43-+I2+H2O是可逆反应.设计如图装置(C1、C2均为石墨电极),分别进行下述操作.I.向B烧杯中逐滴加入浓盐酸
II.向B烧杯中逐滴加入40%NaOH溶液结果发现电流计指针均发生偏转.
据此,下列判断正确的是( )
查看习题详情和答案>>
如图是部分元素的单质和化合物之间的相互转化关系,部分反应的生成物没有全部列出.已知原料A、M均属于金属氧化物,L是由两种沉淀组成的.F和Y反应能生成一种全部为非金属元素所组成的盐,C的焰色反应呈黄色,M有磁性,反应①中B和C的物质的量之比为3:4.
回答下列问题:
(1)反应②的主要用途是:
(2)已知反应③中还有一种无色气体生成,写出反应③的离子方程式:
(3)L中两种沉淀为
(4)若将M溶于稀硫酸中可形成溶液Z,请设计简单的实验,证明Z溶液中所含的金属阳离子:

查看习题详情和答案>>
回答下列问题:
(1)反应②的主要用途是:
冶炼金属或焊接钢轨
冶炼金属或焊接钢轨
(答一点即可,2分),Y的空间构型为三角锥型
三角锥型
.(2)已知反应③中还有一种无色气体生成,写出反应③的离子方程式:
3Fe3O4+28H++NO3-=9Fe3++NO+14H2O
3Fe3O4+28H++NO3-=9Fe3++NO+14H2O
.(3)L中两种沉淀为
Fe(OH)3、Al(OH)3
Fe(OH)3、Al(OH)3
(用化学式表示),A的化学式为Na2O2
Na2O2
.(4)若将M溶于稀硫酸中可形成溶液Z,请设计简单的实验,证明Z溶液中所含的金属阳离子:
分别取少量乙溶液于两支洁净的试管中,向第一支试管中滴加硫氰化钾溶液,溶液变血红色,证明有Fe3+,向第二只试管中,滴加少量酸性高锰酸钾溶液,振荡,高锰酸钾紫色褪去,证明含有Fe2+
分别取少量乙溶液于两支洁净的试管中,向第一支试管中滴加硫氰化钾溶液,溶液变血红色,证明有Fe3+,向第二只试管中,滴加少量酸性高锰酸钾溶液,振荡,高锰酸钾紫色褪去,证明含有Fe2+
.
在固定体积的密闭容器中进行如下反应:2SO2(g)+O2(g)?2SO3(g).已知反应过程某一时刻SO2,O2,SO3浓度(mol/L)分别为0.2,0.1,0.2,达到平衡时,浓度可能正确的是( )
| A、SO2为0.4mol/L | B、SO2为0.25mol/L | C、O2为0.2mol/L | D、O2为0mol/L |