网址:http://m.1010jiajiao.com/timu3_id_403564[举报]
从含银、铜、金和铂的金属废料中提取金、银、铂的一种工艺如下:
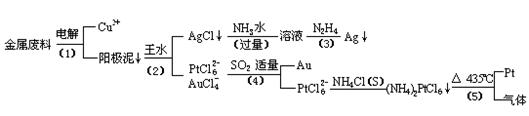
根据以上工艺回答下列问题:
电解时,以金属废料为阳极,纯铜为阴极,CuSO4溶液为电解液,写出电解方程式:
阳极:
阴极: ;
(2)AgCl溶于氨水后所得的溶液含有的一种阳离子,在碱性条件下,也可用葡萄糖将其还原为银,写出该反应的离子方程式:
;
(3)写出步骤(4)的离子反应方程式:
;
(4)金和浓硝酸反应的化学方程式为:
Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O
但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,试简要解释之:
。
查看习题详情和答案>>从含银、铜、金和铂的金属废料中提取金、银、铂的一种工艺如下:
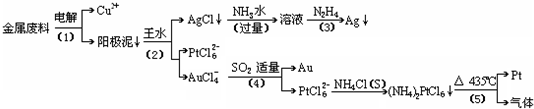
根据以上工艺回答下列问题:
(1)电解时,以______为阳极,纯铜为阴极,CuSO4溶液为电解液,则阳极的电极反应式为:______
(2)AgCl溶于氨水后所得的溶液含有的一种阳离子,在碱性条件下,也可用葡萄糖将其还原为银,写出该反应的离子方程式:______;
(3)写出步骤(4)的离子反应方程式:______;
(4)王水是______的混合液,其体积比为:______
(5)金和浓硝酸反应的化学方程式为:Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O
但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,试简要解释之:______.
查看习题详情和答案>>
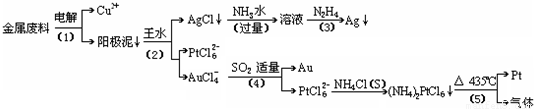
根据以上工艺回答下列问题:
(1)电解时,以______为阳极,纯铜为阴极,CuSO4溶液为电解液,则阳极的电极反应式为:______
(2)AgCl溶于氨水后所得的溶液含有的一种阳离子,在碱性条件下,也可用葡萄糖将其还原为银,写出该反应的离子方程式:______;
(3)写出步骤(4)的离子反应方程式:______;
(4)王水是______的混合液,其体积比为:______
(5)金和浓硝酸反应的化学方程式为:Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O
但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,试简要解释之:______.
查看习题详情和答案>>
从含银、铜、金和铂的金属废料中提取金、银、铂的一种工艺如下:
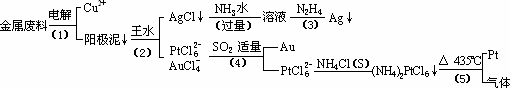
根据以上工艺回答下列问题:
(1)电解时,以金属废料为阳极,纯铜为阴极,CuSO4溶液为电解液,写出电解方程式:
阳极:________
阴极:________;
(2)AgCl溶于氨水后所得的溶液含有的一种阳离子,在碱性条件下,也可用葡萄糖将其还原为银,写出该反应的离子方程式:________;
(3)写出步骤(4)的离子反应方程式:________;
(4)金和浓硝酸反应的化学方程式为:
Au+6HNO3(浓)![]() Au(NO3)3+3NO2↑+3H2O
Au(NO3)3+3NO2↑+3H2O
但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,试简要解释之:________.
从含银、铜、金和铂的金属废料中提取金、银、铂的一种工艺如下:
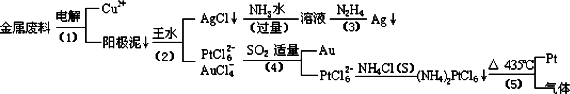
根据以上工艺回答下列问题:
(1)电解时,以金属废料为阳极,纯铜为阴极,CuSO4溶液为电解液,写出电解反应的阳极方程式:________
(2)写出步骤(4)的离子反应方程式:________;
(3)金和浓硝酸反应的化学方程式为:Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,试简要解释之:________.
(4)我们知道,稀盐酸与铜不反应.在稀盐酸中加入H2O2等氧化剂后,则可使铜顺利溶解.某同学未加入氧化剂,而是设计了一个实验装置,也能使铜溶于稀盐酸.请在方格中画出该装置:
(5)分别将等质量的铜片与分别等体积、过量的浓硝酸、稀硝酸反应,所得到的溶液前者呈绿色,后者呈兰色,甲同学提出可能是Cu2+浓度不同引起的,乙同学提出溶液呈“绿色”是溶液中Cu2+与NO2共存的结果,请你设计实验探究甲乙两同学的说法谁更正确(简述实验方案和实验现象及由此得出的结论:________________