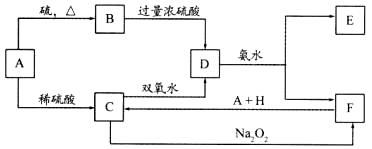
25.(10分):中学教材上有如下介绍:在氢氧化钠浓溶液中加入氧化钙,加热,制成的白色固体就是碱石灰。有两个实验小组的同学决定通过实验探究碱石灰的组成。
(1)第一小组设计方案的流程如图所示:
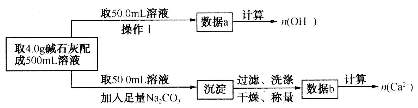
①写出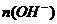 、
、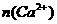 和
和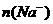 的关系:
的关系: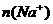 =
。
=
。
②设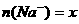 mol、
mol、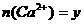 mol,请填写下表:
mol,请填写下表:
|
碱石灰的 可能组成 |
NaOH、CaO |
NaOH、CaO、 Ca(OH)2 |
NaOH、 Ca(OH)2 |
NaOH、Ca(OH)2、 H2O |
|
n(Na+)和 n(Ca2+)的关系 |
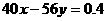 |
|
|
|
(2)第二小组同学查得如下资料:Ca(OH)2在250℃时不分解、NaOH在580℃时不分解。他们设计了如下方案并得出相关数据:取市售碱石灰4.0g,在250℃时加热至恒重,测得固体质量减少了0.60g,剩余固体在580℃C继续加热至恒重,固体质量又减少了0.70g。请通过计算确定该碱石灰各成分的质量分数。
2008学年启东中学高考模拟试卷(八)
24.(8分)丁烷在一定条件下可以按两种方式裂化:C4H10→C2H6+C2H4,C4H10→CH4+C3H6。现对发生裂化反应后的裂化气(不含丁烷)进行研究。
(1)探究裂化气的热值。已知:
|
气体 |
CH4 |
C2H6 |
C2H4 |
C3H6 |
|
燃烧热/(kJ/mol) |
Q1 |
Q2 |
Q3 |
Q4 |
①若44.8L(标准状况)裂化气充分燃烧放出热量Q kJ,则Q的取值范围介于: -
(用Q1、Q2、Q3、Q4表示,下同)。
②若将44.8L气体缓缓通过盛有足量溴的四氯化碳溶液中,发现洗气瓶增重33.6g,则44.8L(标准状况)气体完全燃烧放出的热量Q= kJ.
(2)测量与H2加成反应后气体总体积与氢气的体积分数的关系。
另取裂化气与H2混合得5L混合气体,已知其中H2的体积分数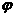 (H2)
(H2)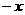 ,在一定条件下使其充分反应,反应后气体的体积为V L。请列出V与
,在一定条件下使其充分反应,反应后气体的体积为V L。请列出V与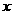 的函数关系式。
的函数关系式。
19.(8分)1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进 行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。
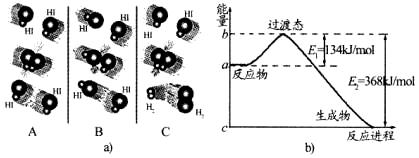
(1)上图是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是 (填“A”、“B”或“C”)。
(2)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。图b是NO2和CO反应生成CO2和NO过程中能量变化的示意图,请写出NO2和CO反应的热化学方程式: 。
(3)过渡态理论认为,催化剂改变反应速率的原因是改变了反应的途径,对大多数反应而言主要是通过改变过渡态而导致有效碰撞所需要的能量发生变化。请在图b中作出NO2和CO反应时使用催化剂而使反应速率加快的能量变化示意图。
(4)进一步研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关。键能可以简单的理解为断开1mol化学键时所需吸收的能量。下表是部分化学键的键能数据:
|
化学键 |
P-P |
P一O |
O一O |
P-O |
键能/(kJ·mol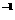 ) ) |
197 |
360 |
499 |
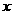 |
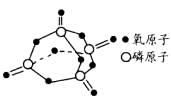
已知白磷的燃烧热为2378.0
kJ/mol,白磷完全燃烧的产物结构如下图所示,则上表中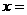 。
。
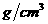 的溶液,浓度越大,密度越小
的溶液,浓度越大,密度越小
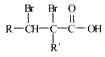
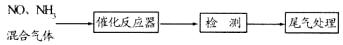
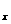 的反应。将该催化剂分别用于催化还原含等物质的量NO
的反应。将该催化剂分别用于催化还原含等物质的量NO