18.(8分)如下图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体均已换算为标准状况下的数值)。
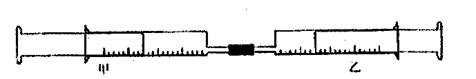
|
实验序号 |
甲针筒内物质 |
乙针筒内物质 |
甲针筒的现象 |
|
1 |
铜片 |
浓硝酸 |
溶液变蓝色,产生红棕色气体 |
|
2 |
10mL,FeCl3溶液 |
1mL KSCN稀溶液 |
|
|
3 |
0.1mol·L-1FeBr2溶液10mL |
22.4mL Cl2 |
溶液变橙黄色 |
|
4 |
0.05mol·L-1MaOH溶液30mL |
22.4mL CO2 |
气体全部溶解 |
试回答下列问题:
(1)实验1中,写出发生反应的离子方程式 。
(2)实验2甲针筒的现象是: 。
(3)实验3中,写出反应的离子方程式 。
(4)实验4中,产物为 。
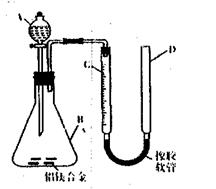 19.(15分)某化学兴趣小组用下图所示装置测定铝镁合金薄片中铝质量分数和铝的相对原子质量。(铁架台等固定装置已略去)
19.(15分)某化学兴趣小组用下图所示装置测定铝镁合金薄片中铝质量分数和铝的相对原子质量。(铁架台等固定装置已略去)
回答下列问题:
(1)实验前检查装置气密性的方法是
。
(2)实验前,先将铝镁合金薄片用砂纸打磨,其目的是 。
(3)A中试剂为 。
(4)经检查装置气密性完好后,将药品和水装入各仪器中,连接好装置,需进行的操作还有:①记录C中的液面位置;②将B中剩余固体过滤、洗涤、干燥、称重;③待B中还有气体产生,恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂。上述操作的顺序是 (填序号);记录C的液面位置时,除视线平视外,还应 。
(5)B中发生反应的化学方程式为 。
(6)若实验用铝镁合金薄片的质量为m g(打磨后称量),测得产生气体的体积为V ml.(已换算为标准状况),B中剩余固体的质量为n g,试计算铝的相对原子质量。
(7)合金薄片中铝的质量分数的表达式为 。
|
(1)X、Y各自的最高价氧化物对应的水化物可以发生反应生成盐和水,该反应的离子方程式为 。
(2)X与W可形成化合物X2W和X2W2两种化合物,X2W2的电子式为 。
(3)Q与W可形成化合物QW2,这种化合物固态时属于 晶体。
(4)Y的硝酸盐水溶液显 性,用离子方程式解释原因
。
(5)Z的氢化物与W的氢化物发生反应生成Z的单质和水,其化学方程式为
。
(6)W、X、Y、Z四种元素原子半径由大到小的顺序是: (用元素符号表示)
(7)0.5mol Q 的单质与足量的W单质完全反应,放出196.75kJ的热量。写出该反应的热化学方程式: 。
17.(10分)由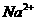 、
、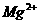 、
、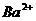 、
、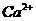 、
、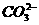 、
、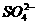 、
、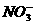 中五种离子形成的三种常见化合物组成某固体混合物。将该混合物进行如下实验:
中五种离子形成的三种常见化合物组成某固体混合物。将该混合物进行如下实验:
a.取少许固体混合物放入水中得到无色溶液和白色沉淀。
b.取溶液进行焰色反应,火焰呈黄色。
c.取白色沉淀加入稀盐酸,沉淀完全溶解并放出气体。
(1)肯定不存在的离子是 ,理由是 。
(2)不可能同时存在的离子是 ,理由是 。
(3)如果三种化合物均为可溶物,则该混合物的组成可能是
或 (写两组化合物化学式)。
(4)如果三种化合物中有两种是难溶物,则该混合物的组成可能是 。
15.在aL含A12(SO4)3和(NH4)2SO4的混合溶液中加入bmol的BaC12,恰好使溶液中的SO42-完全沉淀;如加入足量强大厂加热可得到c mol NH3,则原溶液中的A13+的浓度(mol/L)为 ( )
A.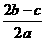 B.
B.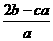 C.
C.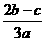 D.
D.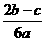
第Ⅱ卷(非选择题,共55分)
|
用黑色墨水的签字笔或钢笔直接在答题卡上每题对应答题区域内,答在试题卷上无效。
11.下列反应的离子方程式正确的是 ( )
A.用FeC13溶液腐蚀印刷电路板:Fe3++Cu Fe2++Cu2+
B.酸性条件下KIO3溶液与KI溶液发生反应生成I2:
IO3-+5I-+3H2O 3I2+6OH-
C.用银氨溶液检验乙醛中的醛基:
|
 CH3CHO+2Ag(NH3)2++2OH- CH3COO-+NH4++3NH3+2Ag↓+H2O
CH3CHO+2Ag(NH3)2++2OH- CH3COO-+NH4++3NH3+2Ag↓+H2O
D.过量的CO2通入Ca(CIO)2溶液中CIO-+CO2+H2O HCO3-+HC1O
9. 工业以上CaO和HNO3为原料制备Ca(NO3)2·4H2O晶体。为确保制备过程中既不补充水份,也无多余的水分,所用硝酸溶液中溶质的质量分数应为 ( )
A.30% B.63% C.70% D.无法计算
|
A.只能为2 B.只能为3
C.只能为2,也可能为3 D.无法确定
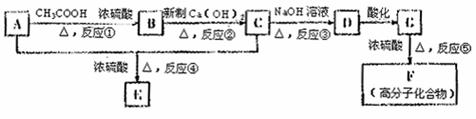
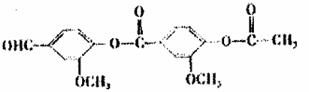
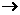 C的化学方程式: 。
C的化学方程式: 。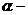 羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构如图所示,下列相关说法不正确的是 ( )
羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构如图所示,下列相关说法不正确的是 ( )