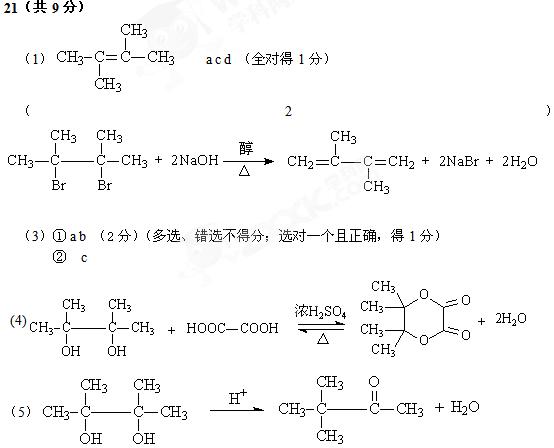
20.(共11分)
Ⅰ.(1)分液漏斗
|
B中棉花位置 |
① |
② |
③ |
④ |
|
所蘸试剂 |
|
|
|
|
|
现象 |
变红 |
褪色 |
|
|
|
体现的性质 |
|
|
还原性 |
|
(2)I2+SO2+2H2O = 4H++SO42-+2I-
Ⅱ.(1) H2SO4
(2)Cl2+2I- = I2+2Cl- b
(3)先由紫色变红色,后褪色
(4)5Cl2+I2+6H2O = 10Cl-+2IO3-+12H+,(2分)
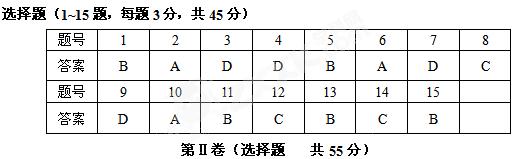
20.(共11分)用如下装置可以完成一系列实验(图中夹持装置已略去)。
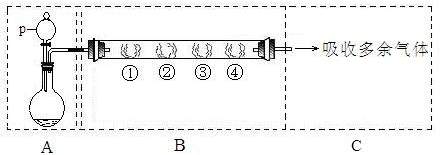
请回答下列问题:
I.(1)仪器p的名称是 。若用装置A选用浓硫酸和亚硫酸钠固体制取SO2气体(根据需要可以加热),并通过装置B完成表中设计实验,请填写表中空白:
|
B中棉花的位置 |
① |
② |
③ |
④ |
|
所蘸试剂 |
石蕊试液 |
品红溶液 |
淀粉和碘水混合液 |
氢硫酸 |
|
现象 |
|
|
褪色 |
浅黄色 |
|
体现SO2的性质 |
水溶液显酸性 |
漂白性 |
|
氧化性 |
(2)写出③中反应的离子方程式:
II.若用装置A选用浓硫酸和浓盐酸混合制取HCl气体,装置B中的四处棉花依次做了如下处理:①包有某固体物质、②蘸有KI溶液、③蘸有石蕊溶液、④蘸有浓NaOH溶液。回答下列问题:
(1)p中盛装试剂的化学式为 。
(2)反应开始后,观察到②处有棕黄色物质产生,写出②处发生反应的离子方程式 。①处包有的某固体物质可能是 。
a.MnO2 b.KMnO4 c.KCl d.Cu
(3)在实验过程中,在③处能观察到 。
(4)反应较长时间后,②处有棕黄色褪去,生成无色的IO3-,写出该反应的离子方程式: 。
19. (共8分)蛇纹石矿可以看作由MgO、Fe2O3、Al2O3和SiO2组成。某实验小组设计如下流程欲分别制得单质Al、Fe、Mg和Si。
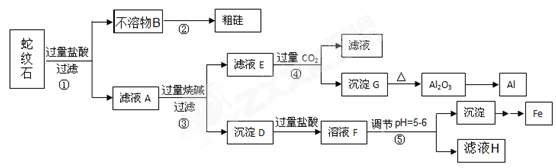
有关氢氧化物沉淀的pH见下表:
|
金属阳离子 |
氢氧化物开始沉淀时的pH |
氢氧化物完全沉淀时的pH |
|
Fe3+ |
1.9 |
3.2 |
|
Mg2+ |
9.4 |
11.6 |
(1)溶液A中含有的阳离子有 。
(2)操作②中涉及的化学方程式为 。
操作④中生成沉淀G的离子方程式为 。
(3)操作⑤中调节pH到5-6时,可以用到的试剂(填序号) 。
a. NaOH溶液 b.氨水 c. MgO d. Mg (OH)2
(4)从滤液H制取金属Mg的流程如下:
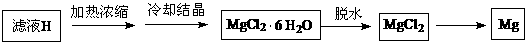
流程中冶炼镁的方法是 。在干燥的HCl气流中加热MgCl2·6H2O制取无水氯化镁的原因是 。
18.(共9分)有关元素X、Y、Z、D、E的信息如下
|
元 素 |
有关信息 |
|
X |
元素主要化合价为–2,原子半径为0.074 nm |
|
Y |
所在主族序数与所在周期序数之差为4 |
|
Z |
原子半径为0.102 nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰 |
|
D |
最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子 |
|
E |
单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
请回答下列问题:
(1)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为 。
(2)E元素与Y元素可形成 EY2 和 EY3 两种化合物,下列说法正确的是(填序号) 。
① 保存EY2溶液时,需向溶液加入少量E单质
② 通常实验室配制EY3溶液时,直接用水溶解EY3固体
③ EY2只能通过置换反应生成,EY3只能通过化合反应生成
④ 铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
⑤ 向淀粉碘化钾溶液和苯酚溶液中分别滴加几滴EY3的浓溶液,原无色溶液都变为紫色
(3)用化学符号表示D2Z的水溶液中各粒子的浓度关系,如c(Z2-)= 。
(4)将一定量的Y单质通入一定浓度的苛性钾溶液中,
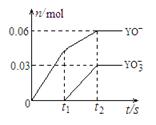 两者恰好完全反应(已知反应过程放热),生成物中有三种
两者恰好完全反应(已知反应过程放热),生成物中有三种
含Y元素的离子,其中两种离子的物质的量(n)与反应
时间(t)的变化示意图如右图所示。该苛性钾溶液中KOH
的质量是 ,该反应中转移电子
的物质的量是 。
 (共5分)
(共5分) 
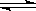 CO2(g)+3H2(g);△H > 0
CO2(g)+3H2(g);△H > 0 
 说明:1. 合理答案均可酌情给分,但不得超过原题分数。
说明:1. 合理答案均可酌情给分,但不得超过原题分数。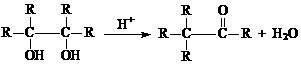 (-R为烃基),请写出E在酸性条件下生成G的化学反应方程式:
。与G分子式相同,能发生银镜反应,且结构中有两个甲基的异构体共有
种。
(-R为烃基),请写出E在酸性条件下生成G的化学反应方程式:
。与G分子式相同,能发生银镜反应,且结构中有两个甲基的异构体共有
种。