摘要:20. Ⅰ.(1)分液漏斗 B中棉花位置 ① ② ③ ④ 所蘸试剂 现象 变红 褪色 体现的性质 还原性 (2)I2+SO2+2H2O = 4H++SO42-+2I- Ⅱ.(1) H2SO4 (2)Cl2+2I- = I2+2Cl- b (3)先由紫色变红色.后褪色 (4)5Cl2+I2+6H2O = 10Cl-+2IO3-+12H+.
网址:http://m.1010jiajiao.com/timu3_id_400219[举报]
(2007?资阳二模)某学生用如图所示装置制取氯气,并收集氯气进行实验.清回答下列问题: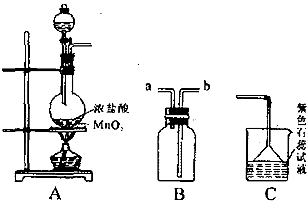
(1)装置A发生反应的离子方程式为
(2)装置 B 如图所示放置,则连接 A 的导管口是(填管口字母)
(3)实验中可观察到C 处石蕊试液的现象是
(4)取出 B 中的集气瓶进行氯气与铜的燃烧实验:首先进行的操作是
(5〕Cl2可与甲苯在光照条件下反应生成一氯甲苯,一氯甲苯进一步水解,可得某种香精的原料苯甲醇.为了获得较纯的一氯甲苯,同时回收未反应的甲苯应采用
A.分液漏斗 B.酒精灯 C.铁架台 D.蒸馏烧瓶 E.短颈漏斗 F.水冷凝管
G.玻璃捧 H.温度计 I.尾接管 J.烧杯 K.锥形瓶.
查看习题详情和答案>>

(1)装置A发生反应的离子方程式为
MnO2+4H++2C1-
Mn2++C12↑+2H2O
| ||
MnO2+4H++2C1-
Mn2++C12↑+2H2O
| ||
(2)装置 B 如图所示放置,则连接 A 的导管口是(填管口字母)
b
b
;(3)实验中可观察到C 处石蕊试液的现象是
先变红后褪色
先变红后褪色
,其原因是C中生成的氯化氢溶液使石蕊变红色,生成的次氯酸具有漂白性使红色褪去
C中生成的氯化氢溶液使石蕊变红色,生成的次氯酸具有漂白性使红色褪去
;(4)取出 B 中的集气瓶进行氯气与铜的燃烧实验:首先进行的操作是
用坩埚钳夹住一束铜丝灼烧
用坩埚钳夹住一束铜丝灼烧
,然后立刻放入充满氯气的集气瓶中;实验过程中有同学提出应该在集气瓶底先放少量的水或细沙,你认为不需要
不需要
(填“需要”或“不需要”),理由是实验过程中生成的是棕黄色烟,不是温度较高的固体熔融物,不会炸裂瓶底
实验过程中生成的是棕黄色烟,不是温度较高的固体熔融物,不会炸裂瓶底
;(5〕Cl2可与甲苯在光照条件下反应生成一氯甲苯,一氯甲苯进一步水解,可得某种香精的原料苯甲醇.为了获得较纯的一氯甲苯,同时回收未反应的甲苯应采用
分馏
分馏
方法将其分离,在分离时需要的玻璃仪器有BDFHIK
BDFHIK
(填序号).A.分液漏斗 B.酒精灯 C.铁架台 D.蒸馏烧瓶 E.短颈漏斗 F.水冷凝管
G.玻璃捧 H.温度计 I.尾接管 J.烧杯 K.锥形瓶.