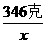7.

 有一包固体混合物,含有硝酸钠和不溶性杂质,在一定量的水中加热,充分溶解。测试结果如表一:
有一包固体混合物,含有硝酸钠和不溶性杂质,在一定量的水中加热,充分溶解。测试结果如表一:
|
温度(℃) |
10 |
40 |
75 |
|
剩余固体(克) |
20l |
132 |
72 |
已知硝酸钠在各温度时的溶解度如表二:
|
温度(℃) |
10 |
25 |
40 |
50 |
55 |
60 |
65 |
75 |
80 |
|
溶解度(克) |
8l |
92 |
104 |
114 |
1l7 |
124 |
130 |
150 |
166 |
求:(1)此实验中所用水的质量是多少;


 (2)原固体混合物中含硝酸钠多少;
(2)原固体混合物中含硝酸钠多少;


 (3)要完全溶解固体混合物中的硝酸钠,所需的最低温度是多少。
(3)要完全溶解固体混合物中的硝酸钠,所需的最低温度是多少。


 [解] 本题的突破口是从上表中可知40℃肯定是硝酸钠的饱和溶液,从10℃升温到
[解] 本题的突破口是从上表中可知40℃肯定是硝酸钠的饱和溶液,从10℃升温到


 40℃,在这些水中多溶解了硝酸钠固体的质量是20l克-132克=69克。而从10℃升温到
40℃,在这些水中多溶解了硝酸钠固体的质量是20l克-132克=69克。而从10℃升温到


 40℃,硝酸钠的溶解度增大了104克-81克=23克,即100克水中能多溶解硝酸钠23克,则易得解。
40℃,硝酸钠的溶解度增大了104克-81克=23克,即100克水中能多溶解硝酸钠23克,则易得解。


 (1)设实验所用水的质量为x
(1)设实验所用水的质量为x


 (104克-81克):100克=(201克-132克):x
(104克-81克):100克=(201克-132克):x


 x=300克
x=300克


 (2)设10℃时300克水中已溶硝酸钠的质量为y,
(2)设10℃时300克水中已溶硝酸钠的质量为y,


 100克:81克=300克:y
100克:81克=300克:y


 y=243克
y=243克


 即原固体混合物的总质量为243克+201克=444克
即原固体混合物的总质量为243克+201克=444克


 再设75℃时300克水中最多可溶硝酸钠的质量为z
再设75℃时300克水中最多可溶硝酸钠的质量为z


 100克:150克=300克:z
100克:150克=300克:z


 z=450克>444克
z=450克>444克


 所以75℃时所得溶液一定是不饱和的,最后剩下的72克固体都是不溶性杂质。
所以75℃时所得溶液一定是不饱和的,最后剩下的72克固体都是不溶性杂质。


 则原固体混合物中硝酸钠的质量为444克-72克=372克
则原固体混合物中硝酸钠的质量为444克-72克=372克


 (3)设300克水溶解372克硝酸钠刚好饱和时,硝酸钠的溶解度为S
(3)设300克水溶解372克硝酸钠刚好饱和时,硝酸钠的溶解度为S


 S=
S=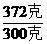 ×100克-124克
×100克-124克


 对照表二可知,所需最低温度为60℃。
对照表二可知,所需最低温度为60℃。


 第18课时
第18课时
4.

 根据溶质质量、溶剂质量的变化情况,以及变化所得的结果,在表中填上相应的文字。
根据溶质质量、溶剂质量的变化情况,以及变化所得的结果,在表中填上相应的文字。
|
溶液中各部分变化情况 |
溶质质量 |
不变 |
不变 |
增加 |
减少 |
|
溶剂质量 |
减少 |
增加 |
不变 |
不变 |
|
|
变化结果 |
溶液质量 |
减少 |
增加 |
增加 |
减少 |
|
溶液浓度 |
变大 |
变小 |
变大 |
变小 |


 [科学探究]
[科学探究]


 一、有关溶液稀释问题的计算
一、有关溶液稀释问题的计算


 1.溶液稀释就是往浓溶液中加溶剂变成稀溶液的过程。
1.溶液稀释就是往浓溶液中加溶剂变成稀溶液的过程。


 2.溶液稀释问题的特点是:稀释前后溶液中溶质质量保持不变,即:浓溶液的质量×浓溶液中溶质的质量分数= 稀溶液的质量×稀溶液中溶质的质量分数 。
2.溶液稀释问题的特点是:稀释前后溶液中溶质质量保持不变,即:浓溶液的质量×浓溶液中溶质的质量分数= 稀溶液的质量×稀溶液中溶质的质量分数 。


 3.由于液体称量比较麻烦而用量筒量取体积比较方便,所以计算时有时会牵涉到溶液的体积,这时要通过 密度
来进行计算(公式为ρ=
3.由于液体称量比较麻烦而用量筒量取体积比较方便,所以计算时有时会牵涉到溶液的体积,这时要通过 密度
来进行计算(公式为ρ= 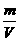 )。
)。


 4.由于分子间存在一定的间隔,所以两种不同液体混合溶解时,体积不能简单相加。(混合后体积 小于
混合前两种液体之和)
4.由于分子间存在一定的间隔,所以两种不同液体混合溶解时,体积不能简单相加。(混合后体积 小于
混合前两种液体之和)


 二、有关溶液浓缩问题的计算
二、有关溶液浓缩问题的计算


 溶液的浓缩问题思考方法可以与稀释问题一样来考虑。
溶液的浓缩问题思考方法可以与稀释问题一样来考虑。


 三、配制一定溶质的质量分数的溶液
三、配制一定溶质的质量分数的溶液


 1.实验步骤:(1)计算;(2)称量;(3)溶解。
1.实验步骤:(1)计算;(2)称量;(3)溶解。


 2.配制50克10%的氯化钠溶液的实验。
2.配制50克10%的氯化钠溶液的实验。


 [典型例题解析]
[典型例题解析]


 [例1] 工业生产上,有时要用溶质的质量分数为10%的稀硫酸来清洗钢材。把50千克溶质的质量分数为98%的浓硫酸稀释成溶质的质量分数为10%的稀硫酸,需要水多少千克?
[例1] 工业生产上,有时要用溶质的质量分数为10%的稀硫酸来清洗钢材。把50千克溶质的质量分数为98%的浓硫酸稀释成溶质的质量分数为10%的稀硫酸,需要水多少千克?


 [解析] 由于稀释前后溶质质量不变。
[解析] 由于稀释前后溶质质量不变。


 设:稀硫酸的质量为x
设:稀硫酸的质量为x


 50千克× 98%=x×10%
50千克× 98%=x×10%


 x=
x=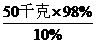 =490千克
=490千克


 则需要水的质量为:490千克-50千克=440千克。
则需要水的质量为:490千克-50千克=440千克。


 [答] 略
[答] 略


 [例2] 配制1 000毫升溶质的质量分数为10%的稀硫酸,需要溶质的质量分数为98%的浓硫酸多少毫升?需要水多少毫升?(硫酸溶液的密度请查阅p.36表)
[例2] 配制1 000毫升溶质的质量分数为10%的稀硫酸,需要溶质的质量分数为98%的浓硫酸多少毫升?需要水多少毫升?(硫酸溶液的密度请查阅p.36表)


 [解析] 查书中表得溶质的质量分数为10%的硫酸溶液的密度为1.07克/厘米3,溶质的质量分数为98%的浓硫酸的密度为1.84克/厘米3。
[解析] 查书中表得溶质的质量分数为10%的硫酸溶液的密度为1.07克/厘米3,溶质的质量分数为98%的浓硫酸的密度为1.84克/厘米3。


 设:需溶质的质量分数为98%的浓硫酸的体积为V
设:需溶质的质量分数为98%的浓硫酸的体积为V


 稀硫酸溶液的质量为:1000毫升×1.07克/厘米3=1070克
稀硫酸溶液的质量为:1000毫升×1.07克/厘米3=1070克


 溶质的质量为:1070克×10%=107克
溶质的质量为:1070克×10%=107克


 所以V×1.84克/厘米3×98%=107克
所以V×1.84克/厘米3×98%=107克


 V=59.3厘米3
V=59.3厘米3


 浓硫酸的质量:59.3厘米3×1.84克/厘米3=109.2克
浓硫酸的质量:59.3厘米3×1.84克/厘米3=109.2克


 加入水的质量:1070克-109.2克=960.8克
加入水的质量:1070克-109.2克=960.8克


 所以加入水的体积为:
所以加入水的体积为: =960.8
=960.8


 厘米3
厘米3


 [答] 略
[答] 略


 [课内练习]
[课内练习]


 1.用溶质的质量分数为40%的浓氢氧化钠溶液(密度为1.43克/厘米3)配制,143克溶质的质量分数为10%的氢氧化钠溶液,需量取40%的氢氧化钠溶液 25
毫升与水(密度为1克/厘米3) 107.25 毫升混合而成。
1.用溶质的质量分数为40%的浓氢氧化钠溶液(密度为1.43克/厘米3)配制,143克溶质的质量分数为10%的氢氧化钠溶液,需量取40%的氢氧化钠溶液 25
毫升与水(密度为1克/厘米3) 107.25 毫升混合而成。


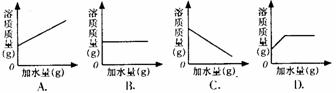
 2.把m克质量分数为a%的NaCl溶液加水稀释,下列图像中正确描述溶液中溶质质量与加水质量关系的是 ( B
)
2.把m克质量分数为a%的NaCl溶液加水稀释,下列图像中正确描述溶液中溶质质量与加水质量关系的是 ( B
)





 3.密度为1.18克/厘米’的浓盐酸(质量分数36%),用100毫升水稀释100毫升浓盐酸,所得稀盐酸的质量分数 ( B
)
3.密度为1.18克/厘米’的浓盐酸(质量分数36%),用100毫升水稀释100毫升浓盐酸,所得稀盐酸的质量分数 ( B
)


 A.等于18% B.大于18% C.小于18% D.无法确定
A.等于18% B.大于18% C.小于18% D.无法确定


 4.配制20%的硫酸溶液490克,需要98%(密度为1.84克/厘米3)的浓硫酸多少毫升?同时需水多少克?
4.配制20%的硫酸溶液490克,需要98%(密度为1.84克/厘米3)的浓硫酸多少毫升?同时需水多少克?


 [解] 设需浓硫酸的体积为V
[解] 设需浓硫酸的体积为V


 V×1.84克/厘米3×98%=490克×20%
V×1.84克/厘米3×98%=490克×20%


 V=54.35厘米3
V=54.35厘米3


 需水体积为=
需水体积为= =390厘米3
=390厘米3


 [课时小结]
[课时小结]


 重点和难点:有关溶液稀释问题的计算。
重点和难点:有关溶液稀释问题的计算。


 课外同步训练
课外同步训练


 [基础过关]
[基础过关]


 1.浓度为10%的食盐溶液100克,将其浓度增加到20%,可采用的方法是 ( D
)
1.浓度为10%的食盐溶液100克,将其浓度增加到20%,可采用的方法是 ( D
)


 A.加入10克食盐固体 B.把溶液中的水蒸发掉一半
A.加入10克食盐固体 B.把溶液中的水蒸发掉一半


 C.加入100克10%的食盐溶液 D.把水蒸发掉50克
C.加入100克10%的食盐溶液 D.把水蒸发掉50克


 2.用浓度为60%的酒精溶液A与25%的酒精溶液B配制成45%的酒精溶液,则A、B溶液的质量比为 ( C
)
2.用浓度为60%的酒精溶液A与25%的酒精溶液B配制成45%的酒精溶液,则A、B溶液的质量比为 ( C
)


 A.1:2 B.2:3 C.4:3 D.3:1
A.1:2 B.2:3 C.4:3 D.3:1


 3.100克A溶液中水的质量分数为98%,现在要使溶液中水的质量分数变为99%,则应加入水的质量为 ( D
)
3.100克A溶液中水的质量分数为98%,现在要使溶液中水的质量分数变为99%,则应加入水的质量为 ( D
)


 A.1克 B.10克 C 50克 D.100克
A.1克 B.10克 C 50克 D.100克


 4.把溶质的质量分数为l0%的硫酸溶液50克浓缩到40克,此时溶液中硫酸的质量分数为 12.5%
。
4.把溶质的质量分数为l0%的硫酸溶液50克浓缩到40克,此时溶液中硫酸的质量分数为 12.5%
。
 食盐晶体。
食盐晶体。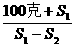 =
=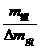
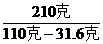 =
=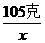
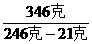 =
=